Фитоиммунология
ИММУНИТЕТ КАК ОБЩЕБИОЛОГИЧЕСКОЕ ЯВЛЕНИЕ. ОСОБЕННОСТИ ИММУНИТЕТА РАСТЕНИЙ.
Многочисленные гетеротрофные организмы постоянно готовы использовать для своего роста и развития готовые органические вещества. Вездесущие микроорганизмы постоянно готовы редуцировать доступные им органическое вещества, даже если эти вещества являются составными частями живого организма. Живые организмы тем или иным способом эффективно защищается от атак со стороны потенциальных редуцентов. Способность противостоять атаке патогенов определяет биологический успех организма. Таким образом, об иммунитете можно сказать так, что это – способность живого организма препятствовать вмешательству в его жизнь гетеротрофного организма, в первую очередь микроорганизма.
В полной мере сказанное относится и к растениям. Растения содержат обильные запасы питательных веществ для потенциальных патогенов. Однако что живые растения в большинстве случаев чувствуют себя вполне нормально, не имеют никаких признаков заболеваний. В то же время если растение или его часть сорвать, то при подходящих условиях оно очень быстро плесневеет и начинает сгнивать, или поедаться отдельными членистоногими и другими животными. Таким образом, живое растение обладает некоторыми особенностями и свойствами, которые позволяют ему весьма успешно противостоять атаке со стороны многочисленных микробов и других живых организмов.
С другой стороны, среди микроорганизмов есть некоторое количество возбудителей болезней растений, которые могут преодолевать защитные механизмы растений и вызывать инфекционные заболевания. Значит, эти возбудители болезней обладают какими-то свойствами, которые отличают их от сапротрофных микроорганизмов, и позволяют паразитировать на растениях.
Фитоиммунология и изучает свойства растений, которые позволяют им противостоять подавляющему большинству потенциальных патогенов, а также свойства микроорганизмов, которые позволяют им паразитировать на растениях.
Иммунитетом растений называется проявляемая ими невосприимчивость к болезни в случае контакта с возбудителями, способными вызывать данную болезнь при наличии необходимых для заражения условий.
В фитоиммунологии часто используют такое понятие, как устойчивость растений. Устойчивость – это широкое общее понятие, под которым понимают способность растений противостоять поражению возбудителем заболевания или повреждению насекомым–фитофагом. Устойчивость может иметь различную степень проявления, и варьирует от отсутствия поражения вообще (то есть от полного иммунитета) до отсутствия какой-либо устойчивости. Противоположным устойчивости есть понятие восприимчивости. Эти два понятия находятся в обратной зависимости, и высокая устойчивость означает низкую восприимчивость, и наоборот. Иммунность растения означает отсутствие восприимчивости.
В то же время, между молекулярно-биохимическими механизмами, обуславливающими иммунность и устойчивость растений, нет качественной разницы. По крайней мере, на сегодняшний день все данные свидетельствуют, что различия между иммунными, устойчивыми и восприимчивыми растениями являются количественными. Поэтому иммунология растений имеет дело и с иммунными, и с устойчивыми растениями. Обычно выражения «иммунитет растений» и «устойчивость растений» рассматриваются как синонимы.
Когда растение вступает в физический контакт с фитопатогенным микроорганизмом, то в самом общем плане удобным является следующее разделение типа возможных взаимоотношений, которые определяют исход такого контакта. Если растение не является хозяином данного микроорганизма, то такие взаимоотношения носят название основной несовместимости. В отношении такого микроорганизма растение является устойчивым по определению, и для устойчивости этого типа обычно используют название устойчивость нехозяина.
Если же растение атакуется фитопатогеном, для которого известно, что в естественных условиях данный микроорганизм может вызывать заболевание данного вида растений, то такие взаимоотношения называют основной совместимостью.
При основной совместимости, если данное растение является восприимчивым к данному биотипу микроорганизма, то есть в результате их взаимодействия происходит заболевание, то такое взаимодействие называют совместимым. Когда данное растение является к данному биотипу патогена устойчивым, то такое взаимодействие называют несовместимым.
Патогенность – способность микроорганизма вызвать заболевание у определенного вида растения.
Вирулентность – этот термин я предлагаю понимать как степень болезнетворной способности патогенного микроорганизма, то есть количественная мера патогенности. О степени вирулентности мы судим по интенсивности проявления симптомов заболевания.
Явление толерантности
Особое положение в фитоиммунологии занимает понятие «толерантность», или выносливость. Под толерантностью понимают способность растений не снижать или почти не снижать урожай даже при сильном поражении фитопатогенным организмом. Явление толерантности имеет неясные механизмы.
Инфекционное заболевание растения происходит тогда, когда имеется в наличие восприимчивое растение, вирулентный фитопатоген, и условия окружающей среды благоприятствуют заболевания. Окружающие условия оказывают достаточно существенное влияние на патологический процесс. Влажность, температура, условия освещенности, присутствие других микроорганизмов влияют на растение, микроорганизм, а также на сам ход патологического процесса. Экологические условия могут как усиливать пораженность растения, так и ослаблять ее. Окружающие условия слабее влияют в случае иммунности растения, но оказывают более заметное действие на степень устойчивости. Например, высокая температура почти всегда снижает устойчивость растения. В связи с этим часто говорят о так называемом «треугольнике болезни», подразумевая под этим треугольником тот факт, что течение конкретного заболевания зависит от устойчивости растения, вирулентности патогена и условий окружающей среды.
Особенности защитных реакций растений. Активный и пассивный иммунитет растений.
Растения, в отличие от позвоночных животных, лишены антител и способности к фагоцитозу; не имеют кровеносной системы и гуморальных факторов иммунитета. Взамен этого каждая растительная клетка должна обладать сформированной заранее и/или индуцируемой защитой; кроме этого, сайт заражения у растений часто является источником системно распространяющегося сигнала, который индуцирует системную приобретенную устойчивость.
У растений, как и у животных, различают два типа иммунитета: врожденный (естественный) и приобретенный (или индуцированный).
Врожденный иммунитет – это свойство растений не поражаться тем или иным возбудителем заболевания, которое обусловлено генотипом растения и передается по наследству.
Все случаи врожденного иммунитета подразделяются на две категории – пассивный иммунитет и активный иммунитет. Пассивный иммунитет существует независимо от наличия паразита, и определяется анатомо-морфологическими или биохимическими особенностями растения, например толщиной кутикулы или содержанием некоторых ингибирующих веществ.
Активный иммунитет проявляется в виде защитных реакций растения на внедрение и воздействие патогена.
Приобретенный иммунитет – это свойство, которое возникает после перенесенного заболевания или при воздействии некоторых химических или физических факторов, в частности ионов металлов или облучения ультрафиолетом.
ЭКОЛОГИЧЕСКИЕ И ТРОФИЧЕСКИЕ ОСОБЕННОСТИ ФИТОПАТОГЕННЫХ ОРГАНИЗМОВ, ТИПЫ ИХ СПЕЦИАЛИЗАЦИИ И ОСОБЕННОСТИ ПАТОГЕНЕЗА
С точки зрения экологических особенностей, точнее по соотношению сапротрофной и паразитической фаз в жизненном цикле микроорганизма, еще великий Антонио де Бари разделил все микроорганизмы на четыре группы: облигатных сапротрофов, факультативных паразитов, факультативных сапротрофов и облигатных паразитов.
С трофической точки зрения фитопатогенные организмы используют одну из трех главных стратегий атаки растения: некротрофию, биотрофию или гемибиотрофию. Некротрофы сначала убивают клетки хозяина, а затем используют их содержимое. Биотрофные патогены вторгаются в живые клетки растения и направляют обмен веществ в сторону поддержки своего собственного роста и репродукции. Гемибиотрофные патогены начинают свое развитие как биотрофы, но убивают окружающие клетки хозяина в течение более поздних стадий инфекции.
Паразитирующие на растениях микроорганизмы имеют различные типы специализации. Самый известный тип специализации имеет отношение к таксонам растений-хозяев, на которых может паразитировать данный фитопатоген. Этот тип специализации можно назвать филогенетической специализацией. На основании этой особенности издавна возбудители болезней растений делят на монофагов, олигофагов и полифагов. Монофаги поражают растения одного вида, одного рода или нескольких близких родов. Олигофаги специализируются в пределах семейства высших растений, и, наконец, полифаги могут поражать растения из разных семейств, порядков и даже классов.
Помимо филогенетической специализации, некоторые фитопатогенные организмы могут развиваться только в определенных тканях или органах растений, то есть имеют тканевую и/или органотропную специализации. Например, возбудитель пузырчатой головни кукурузы поражает только меристематические ткани в разных органах растения; возбудитель рака картофеля поражает столоны и клубни, но не корни.
Особенности патологических процессов, вызываемые фитопатогенными вирусами, бактериями, оомицетами и грибами.
Фитопатогенные вирусы.Большинство фитопатогенных вирусов имеют одноцепочечную (+)РНК, хотя среди них могут встречаться все возможные варианты генома – одно- и двуцепочечные РНК и ДНК. Вироиды имеет короткую кольцевую молекулу РНК, не кодирующую белки.
По тканевой специализации вирусы разделяют на паренхимные и флоэмные. Паренхимные находятся в клетках листовой паренхимы и вызывают различные повреждения. Самый обычный симптом болезней, вызываемых паренхимнымивирусами — чередования темно-зеленых и более светлых участков листа, то есть мозаика.
Вследствие задержки роста светлых участков возникают деформации зараженных листьев — пузыревидные вздутия участков листа, морщинистость вследствие более глубокого расположения жилок, а в некоторых случаях разрушение листовой паренхимы, которая сохраняется только в непосредственной близости от жилок. При некоторых вирусных болезнях светлые участки распределены по листу не случайно, а образуют рисунки в виде колец (кольцевые мозаики), волнистых полос (гравировки) и др. Часто заболевания сопровождаются некротическими поражениями жилок листа (полосчатые мозаики), переходящими на черешки и стебли.
Флоэмные вирусы локализуются во флоэме. Это часто приводит к повреждению флоэмного оттока и скручиванию листьев, переполненных продуктами фотосинтеза. Скручиванием листьев часто болеют картофель и хлопчатник. Многие флоэмные вирусы нарушают обмен фитогормонов, вследствие чего возникают различного рода уродливости — тератоморфы: превращение вегетативных органов в генеративные, пролиферации цветка и отдельных его частей, чрезмерная кустистость, карликовость и др.
Сохранение. Лучший источник сохранения вирусов в зимний период — вегетативные части зараженных растений. Поэтому наибольший урон вирусы наносят растениям, размножаемым вегетативно — картофелю, плодово-ягодным породам, цветочным культурам. Накапливаясь из года в год, вирусы вызывают постепенное снижение продуктивности и изменение присущих сорту признаков, получившие название вырождения. Поскольку большинство вирусов имеет широкий круг хозяев, большую угрозу для сельскохозяйственных растений несет пораженность сорных и дикорастущих растений, в зимующих органах которых могут сохраняться опасные вирусы.
У вирусов растений обнаружена способность сохраняться в семенах, причем число инфицированных семян, сформированных на зараженных растениях, может колебаться от долей до 100%. Наиболее стойкие вирусы, такие как ВТМ, могут сохраняться на поверхности семян.
Некоторые вирусы сохраняются в теле их переносчиков.
Распространение вирусов может быть вертикальное (от родителей потомству) и горизонтальное (от зараженных растений здоровым). Горизонтальное распространение может осуществляться по-разному.
Контактное распространение происходит при соприкосновении листьев или корней зараженных и здоровых растений. При смыкании растений на трущихся друг о друга поверхностях листьев возникают мелкие ранки (например, поломка волосков), через которые содержащий вирусы сок переходит из одного растения в другое. Следовательно, контактная передача возможна только для вирусов, накапливающихся в эпидермальных клетках. Флоэмные вирусы при контакте передаваться не могут. Для таких вирусов, как ВТМ, ХВК, вирус желтой мозаики турнепса контактный способ является преобладающим. Особенно большую угрозу представляет распространение вирусов контактным способом в период ухода за растениями, связанного с их повреждениями — культивация, пасынкование томатов, ломка листьев табака и др.
С помощью прививки передаются все известные вирусы. Такой способ распространения имеет большое значение в плодоводстве, где растения размножают прививкой на подвои. Прививкой распространяются такие вредоносные болезни, как мозаика яблони, розеточность персика, курчавость хмеля.
Некоторые вирусы (карликовости сливы, штриховатости табака, скручивания листьев вишни и др.) могут адсорбироваться на пыльце в складках экзины и распространяться от больных растений к здоровым ветром или насекомыми-опылителями.
Наиболее распространенный в природе способ распространения вирусов — векторный (с помощью переносчиков). Большинство переносчиков вирусов относится к членистоногим животным (насекомым, клещам), имеющим колюще-сосущий ротовой аппарат. Для флоэмных вирусов передача переносчиками — единственный природный способ попадания в восприимчивую ткань (их переносчики питаются флоэмным соком).
По взаимоотношению с переносчиками вирусы разделяют на неперсистентные (или стилетные) и персистентные (циркулятивные). Переносчики неперсистентных вирусов приобретают их очень быстро, в течении 30 с—2 мин. питания (из клеток эпидермиса, ибо за такой короткой период стилет не проникает более глубоко); сразу после питания способны передавать вирусы здоровым растениям и быстро теряют способность к передаче. Так передаются только паренхимные вирусы, причем основной механизм передачи — адсорбция частиц на стилете. Однако только механической адсорбцией на стилете передачу вирусов объяснить нельзя, ибо некоторые вирусы, включая ВТМ, несмотря на высокую концентрацию частиц в соке, насекомыми не передаются; известна определенная взаимная специализация вирусов и переносчиков и даже наличие вирусов-помощников при передаче насекомыми. Например, некоторые вирусы картофеля (аукубы-мозаики и др.) не передаются тлями, однако, если картофель заражен смесью вирусов аукубы-мозаики и У (УВК), оба вируса передаются тлями. Следовательно, УВК служит помощником вируса аукубы-мозаики в передаче тлями. В геноме УВК содержится ген, кодирующий 58 kD белок, названный helper component (HP), способствующий связыванию вирусных частиц с определенными местами стилета. Мутации этого гена делают вирус неспособным к передаче тлями.
Более сложные взаимоотношения с переносчиками имеют персистентные вирусы. Переносчики приобретают вирусы после более длительного периода питания (более 30 минут). К этой группе относятся все флоэмные вирусы. После периода питания необходим определенный латентный период (от нескольких дней до нескольких недель), чтобы насекомое приобрело способность к заражению здоровых растений, однако эта способность сохраняется у него длительный период (иногда в течение всей жизни). Вирусы всасываются с соком, попадают в кишечник, через стенки которого проникают в гемолимфу, разносятся по телу, попадают в слюнные железы, а из них нагнетаются в новое растение. На такую циркуляцию в теле переносчика необходимо время, определяемое как латентный период. В теле переносчиков многие персистентные вирусы размножаются и откладываются в виде кристаллических или аморфных включений. У некоторых цикад вирусные частицы попадают в яйцеклетки и передаются новому поколению.
Ряд вирусов распространяются нематодами и грибоподобными протистами.
Особого упоминания заслуживает вопрос перемещения вирусов по растению. После репродукции в первично зараженной клетке происходит заражение всего растения вследствие перемещения вирусов из клетки в клетку (ближний транспорт) и по флоэме (дальний транспорт).
Ближний транспорт осуществляется через плазмодесмы. Опыты с молекулами декстрана показали, что через плазмодесмы могут проходить только очень мелкие молекулы размером около 1 kD. Однако вирусная нуклеиновая кислота кодирует специальный транспортный белок (ТБ), который содействует переходу через плазмодесмы. Первый такой белок был открыт у ВТМ. Он имеет молекулярную массу 30 kD. Этот белок открывает плазмодесмы, позволяя проходить через них крупным молекулам. Гены, кодирующие синтез транспортных белков, обнаружены и у других вирусов. Таким образом, движение через плазмодесмы осуществляется в форме нуклеопротеида — транспортного белка, соединенного с вирусной РНК. Несколько молекул ТБ связываются с вирусной молекулой РНК и этот комплекс движется по элементам цитоскслета: в цитоплазме по микротрубочкам, вблизи плазмодесм — по филаментам актина, пронизывающим плазмодесмы. Скорость движения вируса гравировки табака составляет 1 клетка за 2 часа.
Дальний транспорт осуществляется флоэмным током, поэтому скорость и направления тока оказывают решающее влияние на распространение вирусов по растению. Давно было показано, что после заражения одного листочка томата ВТМ сначала инфицируется весь зараженный лист, затем — стебель ниже листа и корни, затем — верхушка и после этого — все растение. Движение по флоэме осуществляется как в форме целых частиц, так и в форме нуклеопротеидов, в которых вирусная РНК соединена с белком.
Фитопатогенные грибы и оомицеты
Все ~300 000 видов цветковых растений заражаются патогенными грибами и оомицетами. Однако отдельный вид растения может быть хозяином только нескольких видов грибов, и точно так же большинство грибов обычно имеет ограниченный круг растений–хозяев.
Стратегии, используемые грибными патогенами и оомицетами при заражении растений, являются различными для разных типов взаимодействий с хозяевами. Тем не менее, можно выделить отдельные особенности, которые обусловливают паразитизм грибов и оомицетов.
1. Активное внедрение в растение.
Для колонизации растения, грибы и грибоподобные протисты развили различные стратегии внедрения в растительные ткани. Большинство факультативно паразитических грибов и оомицетов, так же как и фитопатогенные бактерии и некоторые вирусы, для внедрения в растение нуждаются в естественных отверстиях или в повреждении покровных растительных тканей. В противоположность этому, многие другие фитопатогены выработали механизмы активного преодоления структурных наружных барьеров растений, кутикулы и клеточной стенки клетки эпидермиса. Для достижения этой цели, грибы обычно секретируют смесь гидролитических ферментов, включающих кутиназы, целлюлазы, пектиназы и протеазы. Поскольку эти ферменты необходимы также для сапротрофного образа жизни, то они не представляют инструменты, специфически выработанные грибами для обеспечения патогенеза, и каждый гидролитический фермент в отдельности может и не быть абсолютно необходимым для проникновения. Это, однако, не свидетельствует о том, что структуры или регуляция биосинтеза этих ферментов не адаптированы для специфических потребностей патогена на определенном растении-хозяине.
Эксперименты, посвященные выяснению роли кутиназы, иллюстрируют это положение. Кутикула закрывает воздушные части живых растений, и ее нужно преодолеть до того, как другие механизмы патогенности станут эффективными. Поэтому, ферментативная деградация кутина, структурного полимера кутикулы растения, постулировалась как критическая для патогенности грибов, и кутиназа, как предполагается, является ключевым игроком в процессе проникновения. Хотя ряд специалистов ключевую роль кутиназы для проникновения грибов в растения подвергают сомнению.
Альтернативно или в комбинации с гидролитическими ферментами, некоторые грибы развили более сложный и изощренный механизм, чтобы проникнуть через кутикулу растений-хозяев. Вообще, фитопатогенные грибы формируют специализированные органы проникновения, названные аппрессориями, в кончике их ростковых трубок; эти органы прочно присоединены к поверхности растения клейкими внеклеточными веществами. Когда аппрессорий развивается, пористость его стенки у проникающих механическим путем грибов заметно уменьшается за счет включения меланина, и внутри аппрессория развивается очень высокое тургорное давление – >8 мегапаскалей, что в 40 раз выше давления типичных автомобильных шин. Это давление фокусируется на маленькой области в основе аппрессория, которая остается свободной от материала стенки и меланина. Из этой пенетрационной поры развивается инфекционная гифа и проникает через кутикулу и стенку клетки, возможно при определенной помощи гидролитических ферментов.
Высокое тургорное давление в аппрессориях аскомицетов может быть обусловлено многоосновными спиртами, или полиолами. Высокие концентрации глицерола, достаточные, чтобы объяснить тургорное давление, были найдены в аппрессориях M. grisea.
У этого гриба дефицитные по меланину мутанты неспособны заражать интактные растения, но становятся патогенными на листьях с ободранной кутикулой, то есть поврежденных. Таким образом, меланин является существенным фактором патогенности для некоторых грибов, которые проникают в растение механическим путем.
Некоторые другие виды фитопатогенных грибов, включая некоторые ржавчинные грибы, не выработали механизма прямого проникновения, и взамен этого обходят кутикулу и наружные клеточные стенки за счет внедрения через устьица. Эти грибы выработали пока еще плохо понятный механизм обнаружения этих отверстий на поверхности растения.
Таким образом, проникновение грибов в растения контролируется комбинацией различных факторов, и в дополнение к факторам гриба в число этих факторов могут входить структуры поверхности растения, а также активаторы и ингибиторы прорастания спор грибов и формирования ростковых трубок.
2. Нарушение метаболизма растений с помощью токсинов
После проникновения, следующим шагом стратегии гриба в колонизации растения является секреция токсинов или веществ с гормональной активностью, которые изменяют физиологию растения в сторону, благоприятную для патогена. Такое вмешательство в метаболизм растения может состоять просто в убийстве клеток растений и использования их для питания, или в более тонкой переориентации клеточных процессов; часто эта цель достигается выделением продуцирования фитопатогенным грибом фитотоксинов, которые имеют варьирующую степень специфичности по отношению к различным растениям.
Фитотоксины идентифицированы у большого количества патогенов, но их действительная роль в патогенеза в большинстве случаев остается плохо понятной и спорной. Однако, в некоторых взаимодействиях растение-гриб, генетические и биохимические исследования показали, что токсины являются детерминантами специфичности гриба. В этих случаях, устойчивость или восприимчивость к грибу всегда высоко коррелирует с нечувствительностью или чувствительностью к токсину. Эти специфические для хозяина токсины продуцируются в основном грибами родов Alternaria и Cochliobolus.
Специфические фитотоксины.
Специфические токсины по отношению к чувствительным сортам и линиям растений активны при концентрациях в пределах от ~10 pM до 1 μM, и их степени специфики (селективности для хозяина) находятся в диапазоне от 100-кратной до >106-кратной.
Примеры специфических токсинов
T-токсин
T-токсин производится изолятамирасы T C. heterostrophus. Раса T C. heterostrophus очень вирулентная для линий кукурузы, обладающих цитоплазматической мужской стерильностью техасского типа (Tcms). Раса 0 C. heterostrophus, которая не производит T-токсин, является второстепенным патогеном кукурузы независимо от цитоплазмы.
T-токсин активен при ~10 nM у Tcms кукурузы и при ~10 μM у кукурузы с нормальной цитоплазмой. Чувствительны к токсину митохондрии растений. Основа чувствительности к T-токсину – перегруппировка митохондриального генома Tcms растений, которая приводит к синтезу химерного белка URF13, локализованного во внутренней митохондриальной мембране. Физические и биохимические исследования указывают, что URF13 формирует олигомерные поры в мембранах митохондрий в присутствии T-токсина.
Викторин
Викторин был одним из первых обнаруженных специфических токсинов; он имеет высокую токсичность (эффект был зарегистрирован при 10 pM). C. victoriae (возбудитель увядания овса Виктория) отрицательно воздействовал на экономику Соединенных Штатов в течение 1930-ых, вызывая главные эпидемии овса. Происхождение эпидемии увядания Виктории связано с модификацией генома овса. В 1930-ых, серьезной болезнью овса была корончатая ржавчина, вызванная Puccinia coronata. Обнаруженный в Уругвае ген Pc-2 обеспечивает хорошую устойчивость к P. coronata, и он был внедрен в основные сорта овса в Соединенных Штатах, в первую очередь сорт Виктория. Вскоре появилось ранее неизвестное увядание, которое специфически поражало сорта овса с геном Pc-2. Ген, который обеспечивает восприимчивость к C. victoriae, названный Hv-7 или Vb, является или тем же самым геном, что и Pc-2, или очень сильно связанным.
Несмотря на длительное изучение, точный механизм действия викторина остается неизвестным. Предполагается, что он связывается с одной из субъединиц декарбоксилазы глицина (GD) – сложного фермента с 42 субъединицами четырех типов. Фермент локализован в митохондриях и играет центральную роль в цикле фотодыхания. Викторин специфически ингибирует GD в растительных тканях, но он не оказывает никакого эффекта на GD в выделенных, неповрежденных митохондриях, из-за отсутствия поглощения. В интактных тканях, викторин накапливается в митохондриях чувствительных клеток, но не в митохондриях устойчивых клеток. Возможно, продукт гена Hv-7 может контролировать поглощение митохондриями или метаболизм викторина.
HC-токсин
Восприимчивость к C. carbonum раса 1 и чувствительность к его токсину, HC-токсину, контролируется двумя генами кукурузы, Hm1 и Hm2. Устойчивая кукуруза имеет ферментативную активность редуктазы HC-токсина, которая детоксифицирует HC-токсин. Современное доказательство указывает, что сайт действия HC-токсина – деацетилаза гистонов (HD), фермент, который обратимо деацетилирует внутренние гистоны (H3 и H4), когда они собраны в хроматине. Ацетилирование и деацетилирование внутренних гистонов изменяют индуцибельность и супрессивность некоторых классов генов, но детали того, как это происходит, не выяснены. HC-токсин ингибирует HD кукурузы, вызывая накопление ацетилированных гистонов in vivo.
В настоящее время исследователи пытаются понять, как ингибирование активности HD способствует заражению кукурузы C. carbonum раса 1. Одно возможное объяснение действия HC-токсина – то, что он способствует заражению, интерферируя с индукцией генов защиты кукурузы, то есть препятствует индукции защитных реакций растения.
Имеется большое количество других специфических токсинов. Исследования последних лет показали, что специфические фитотоксины не являются попросту метаболическими ядами, убивающими клетки растения. Для проявления их токсического действия необходимо активное участие метаболизма клетки хозяина; например, их токсический эффект не проявляется в случае ингибирования синтеза белка в клетки растения. В последнее время накапливается все больше экспериментальных данных, которые свидетельствуют о том, что гибель клеток растения обусловлена внутренними механизмами и представляет собой фактически защитную реакцию растения – реакцию сверхчувствительности. Если это так, то некротрофные патогены – продуценты специфических фитотоксинов – фактически индуцирую реакцию устойчивости, и в дальнейшем используют ее результат к собственной выгоде.
Неспецифические фитотоксины
Неспецифические фитотоксины активны как для растений-хозяев, так и нехозяев. Такая неселективность, очевидно, противоречит роли для токсина в детерминации диапазона растений-хозяев. Тем не менее, эти токсины могут выполнять определенную функцию в течение патогенеза гриба на конкретном хозяине. Хотя механизм действия неспецифических токсинов остается в большинстве случаев неизвестным, тем не менее есть данные, что они могут затрагивать фундаментальные процессы метаболизма.
Фитопатогенные бактерии. В отличие от грибов и оомицетов, фитопатогенные бактерии не могут проникать через неповрежденные покровные ткани растений. В то же время большинство бактерий являются достаточно маленьким, чтобы проникнуть через устьица и другие естественные отверстия в апопласт.
Большинство фитопатогенных бактерий являются грамотрицательными.
Фитопатогенные бактерии можно разделить на некротрофные и биотрофные. Некротрофными являются, например, Erwinia carotovora E. chrysanthemi, вызывающие мягкие гнили многих растений. Биотрофными являются большинство представителей родов Pseudomonas, Ralstonia и Xanthomonas, а также Erwinia amylovora.
Паразитизм грамотрицательных бактерий зависит от нескольких особенностей. Одна из основных предпосылок – наличие так называемых hrp (гарп) генов. При нарушении функции любого из этих генов бактерии перестают вызывать реакцию сверхчувствительности при заражении растений-нехозяев, а также утрачивают способность к паразитизму на растениях-хозяевах. Иначе говоря, мутанты по генам hrp ведут себя подобно непатогенным бактериям. Таким образом, наличие функциональных генов hrp является обязательным условием для паразитизма фитопатогенных бактерий. Ряд этих генов кодируют компоненты системы секреции белка типа III, которая, по всей видимости, позволяет доставлять бактериальные белки внутрь клеток хозяина.
Наличие генов hrp является необходимым, но недостаточным условием для патогенеза на растениях. Например, когда кластеры этих генов внедряли в сапротрофные бактерии P. fluorescens или E. coli, эти бактерии начинали вызывать реакцию сверхчувствительности у многих растений, но не могли вызвать болезнь, то есть не становились фитопатогенными. Для патогенеза на растениях необходимы дополнительные факторы.
Одним из таких факторов являются эффекторы патологического процесса, чаще всего белковой природы. Эти белки доставляются в растительную клетку системой секреции типа III, и несмотря на то, что их функция плохо понятна, считается, что они в частности подавляют защитные реакции растения.
Кроме этого, имеются другие факторы, обуславливающие вирулентность бактерий. К таким факторам относят в частности токсины. Токсины, продуцируемые некрогенными грамотрицательными патогенами (прежде всего патоварами P. syringae) являются вторичными метаболитами (главным образом маленькие пептиды). Они не выявляют никакой специфичности по отношению к хозяину, типично не вносят вклад в размножение бактерий в растениях, легко диффундируют и часто вызывают характерные повреждения. Бактериальные токсины, как полагают, являются факторами вирулентности.
Фактические роли индивидуальных токсинов в патогенезе все еще неясны. Токсины продуцируются некоторыми нефитопатогенными штаммамиP. syringae, и многие из них также имеют антибактериальную активность и таким образом могут первично функционировать как факторы конкуренции бактерий в течение эпифитной стадии развития. В некоторых случаях гены, обусловливающие биосинтез токсина, могут быть удалены без влияния на патогенность бактерий. В то же время ряд токсинов, как считают, вносят вклад в патологический процесс, по крайней мере, на ранней стадии.
Еще одним фактором вирулентности являются внеклеточные полисахариды. Внеклеточные полисахариды, в отличие от токсинов, производятся большинством бактерий, включая многих патогенов растений, и секретируются как свободная слизь или как материал капсулы. Они, как полагают, защищают свободноживущие бактерии от разнообразных экологических стрессов и могут способствовать патогенезу, поддерживая насыщение водой межклеточного пространства, снижая доступность бактериальных клеток для антибактериальных соединений, нарушая распространение сигналов, активирующих защиту растений, и блокируя ксилему, таким образом, вызывая симптомы увядания. Исследования мутантов этих бактерий выявило, что внеклеточные полисахариды вообще являются фактором вирулентности, внося вклад в формирование симптомов увядания и водянистости тканей. При этом они не являются абсолютно необходимыми для патогенеза, и не имеют никакой специфичности для хозяина. Следует отметить, что фитопатогенные бактерии, как и все остальные бактерии, в естественных условиях образуют биопленки, и динамика развития биопленок и их свойства во многом связаны с составом внеклеточных полисахаридов. В свою очередь этот состав подвержен изменениям в зависимости от этапов развития биопленки и регулируется в частности таким явлением, как ощущение кворума.
Следующим фактором вирулентности бактерий являются пектиназы. Все деградирующие клеточную стенку ферменты бактерий экспортируются из клеток посредством системы секреции типа II. Бактериальная мягкая гниль, вызываемая некротрофными патогенами E. carotovora, E. chrysanthemi и P. viridiflava, существенно отличается от болезней, вызванных биотрофными патогенами. Эти бактерии имеют широкий диапазон хозяев, особенно среди растений с мясистыми паренхиматическими тканями, степень развития болезни больше зависит от экологических условий, которые ослабляют хозяина. Патогенез определяется пектиновыми ферментами, которые расщепляют α-1,4-галактуронозильные связи в полимерах клеточной стенки растения посредством гидролиза (полигалактуроназы) или β-элиминирования (пектат- или пектинлиазы). Из-за структурной важности и уникальной доступности пектиновых полимеров в первичных клеточных стенках и срединных пластинках двудольных и некоторых однодольных растений, пектиновые ферменты – существенное оружие патогенеза с использованием, так сказать, грубой силы, и они вызывают как гибель клеток, так и мацерацию ткани, то есть первичные признаки мягкой гнили.
Патогенез Agrobacterium tumefaciens
Agrobacterium tumefaciens является фитопатогеном почвы, который генетически трансформирует хозяина, вызывая корончатые галловые опухоли, важную болезнь, которая затрагивает большинство двудольных растений. В природе, эти опухоли обычно формируются на границе воздух-почва, так называемой короне растения. В патологическом процессе, ДНК транспортируется из дикого типа Agrobacterium в ядро клетки растения. Экспрессия этой перемещенной ДНК (T-ДНК) имеет результатом неопластический рост (опухоли) на растении-хозяине.
Для трансформации клетки растения требуются три генетических компонента Agrobacterium. Первый компонент – T-ДНК, которая физически транспортируется из бактерии в клетку растения. T-ДНК – дискретный сегмент ДНК, расположенной на 200-kb Ti-плазмиде Agrobacterium; она ограничена двумя 25-bp неполными прямыми повторениями, известными как границы T-ДНК. Второй компонент – 35-kb область вирулентности(vir), также расположенная на Ti плазмиде, которая состоит из семи главных локусов (virA, virB, virC, virD, virE, viG и virH). Белковые продукты этих генов, которые называют белками вирулентности (Vir), отвечают на специфические вещества, секретируемые поврежденным растением, чтобы произвести копию T-ДНК, и опосредуют ее перемещение в клетку хозяина. Третий компонент – набор хромосомных генов вирулентности (chv), расположенных на хромосоме Agrobacterium. Гены chv вовлечены в хемотаксис бактерии и прикрепление к поврежденной клетке растения.
Восприятие сигналов поврежденного растения
Поврежденные растения секретируют сок с характерным кислым pH (от 5.0 до 5.8) и высоким содержанием различных фенольных соединений, типа предшественников флавонидов и лигнина. Эти условия специфически стимулируют экспрессию vir генов Agrobacterium. Лучше всего охарактеризованные и самые эффективныеиндукторы генов vir – моноциклические фенольные вещества типа ацетосирингона (AS). Эти молекулы не обнаружены, или обнаружены на низких уровнях, у неповрежденных растений, но их количество значительно увеличивается в поврежденных клетках растений.
Сигналы растения воспринимаются сенсорной двухкомпонентной системой бактерий, которая состоит из мембранной сенсорной киназы и цитоплазматического регуляторного белка. У Agrobacterium имеется двухкомпонентная система трансдукции сигнала, состоящая из белков вирулентности VirA и VirG. Вместе, эти белковые молекулы чувствуют сигнальные молекулы, секретируемые поврежденными клетками растения, и активируют экспрессию других vir генов, таким образом инициируя процесс транспорта T-ДНК. Сенсорным компонентом является белок VirA, являющийся сенсорной киназой. Сигналы растения активируют VirA, после чего эта киназа автофосфорилируется в остатке His-474, а затем фосфатная группа переносится на остаток аспарагина белка VirG. Белок VirG взаимодействует с так называемым vir-боксом, то есть с консервативной последовательностью из 12 нуклеотидов в регионах промотора индуцибельных vir генов на Ti-плазмиде.
Прикрепление Agrobacterium к клеткам растения-хозяина является предпосылкой для передачи ДНК. Распознавание Agrobacterium–клетка хозяина – процесс из двух шагов. На первом шаге, бактерии свободно связывают с поверхностью клетки хозяина, и на втором связанные бактерии синтезируют нити целлюлозы, которые стабилизируют начальное закрепление, приводя к тесной ассоциации между Agrobacterium и клеткой хозяина.
Показано, что каждая клетка растения связывает конечное число бактерий; поэтому считают, что в связывание вовлечены насыщаемые поверхностные рецепторы растения. У животных белок внеклеточного матрикса витронектин функционирует как рецептор для нескольких бактериальных штаммов. Подобные витронектину молекулы, которые были найдены на поверхности клетки многих видов растений, могут обусловить закрепление Agrobacterium на клетке растения. Витронектин человека, так же как антитела против витронектина, блокируют прикрепление Agrobacterium к культивируемым клеткам растения. Потенциально подобный витронектину белок (PVN) растений может представить один из рецепторов, ответственных за специфическое взаимодействие между Agrobacterium и клетками растения. В дополнение к PVN, другие белки и углеводы поверхности клетки растения, вероятно, могут быть вовлечены во взаимодействие с Agrobacterium. Однако эти молекулы еще не идентифицированы.
Образование переносимой Т-нити
Индукцияэкспрессии генов vir в конечном счете имеет одним из результатов производство копии T-ДНК, которая является способной к генетическому преобразованию клеток растения. Различные типы Ti-плазмид несут элементы T-ДНК различного состава. Например, T-ДНК в нопалиновой Ti-плазмиде – непрерывный отрезок ~22 kb. Интересно, что T-ДНК как таковая не оказывает никакого влияния на эффективность перемещения. Поэтому неонкогенные («разоруженные») Ti-плазмиды, с большинством внутренних последовательностей T-ДНК, замененных интересующей ДНК, широко используются как векторы для генетической трансформации растений.
Клетки Agrobacterium с индуцированными генами vir производят линейную одноцепочечную копию области T-ДНК, называемую T-цепью. T-цепь обнаруживается приблизительно в одной копии на индуцированную клетку Agrobacterium. Белки VirDl и VirD2 вместе функционируют как эндонуклеаза, которая выполняет сайт- и цепь-специфические разрезы в участке границ T-ДНК. После расщепления, VirD2 ковалентно прикрепляется к 5′ концу T-цепи. Вырезаемая T-цепь удаляется, и результирующий одноцепочечный промежуток восстанавливается.
В середине 1990-х годов были получены прямые доказательства, что в клетку растения и в ее ядро перемещается именно одноцепочечная, а не двухцепочечная, ДНК.
Считают, что T-цепь перемещается из бактерии и в клетку растения как комплекс белок–нуклеиновая кислота. Это промежуточное звено транспорта T-ДНК, названное как T-комплекс, состоит, по крайней мере, из трех компонентов, а именно, из самой молекулы ДНК T-цепи, а также связанных с нею белков VirD2 и VirE2, которые защищают T-цепь, формируют ее в передаваемый (тонкой и развернутый) форме и снабжают специфические сигналы нацеливания. После разрезания ДНК Ti-плазмиды при посредстве белков VirDl и VirD2, которые вместе действуют как эндонуклеаза, одна молекула белка VirD2 ковалентно присоединена к каждой T-цепи. Также ассоциированным с T-цепью является белок VirE2, который имеет свойство связывать одноцепочечную ДНК. Связывание VirE2 с одноцепочечной ДНК in vitro является сильным и кооперативным, что приводит к формированию очень устойчивых развернутых комплексов VirE2-ssDNA, которые являются в значительной степени устойчивыми к внешней нуклеолитической активности. На основании данных электронной микроскопии и кинетики связывания белка VirE2 in vitro предполагается, что нопалин-специфические T-комплексы имеют 3600 nm в длину и 2 nm в ширину. Они содержат ~600 молекул VirE2 и одну молекулы VirD2 и имеют предсказанную молекулярную массу 50 000 kD.
Транспорт Т-комплекса в клетку растения
Очевидно, что межклеточный транспорт ДНК требует прямого прохода между донором и реципиентом. Таким образом, Agrobacterium, как предсказывается, формирует канал, через который T-комплексы перемещаются в цитоплазму клетки растения-хозяина. Молекулярный механизм, которым этот проход формируется и функционирует – все еще биологический черный ящик. Однако кажется вероятным, что канал Agrobacterium-клетка растения кодируется virB локусом.
Оперон virB содержит кодирует девять белков, для которых показано, что они ассоциированы с бактериальными мембранами. Эти белки стабилизируют один другого таким образом, что функция некоторых продуктов генов virB зависит от присутствия других VirB белков. Эти данные предполагают, что координированный синтез белка стабилизирует отдельные VirB полипептиды, возможно позволяя им формировать многобелковую структуру. Подобная стабилизация белка через взаимодействия белок-белок была описана в течение формирования некоторых пилей у грамотрицательных бактерий. Подобно генерации T-цепей, формирование VirB канала, по-видимому, эволюционно связано с бактериальной конъюгацией.
Транспорт Т-ДНК в ядро клетки растения
Размер T-комплекса (50 000 kD) предполагает необходимость активных транспортных процессов. Поскольку T-цепь самостоятельно не несет сигналы нацеливания, ядерный импорт T-комплекса наиболее вероятно опосредуется белками VirD2 и VirE2.
Как правило, у эукариот активный ядерный импорт белков требует специфического сигнала ядерной локализации (NLS). Детальные исследования позволили выяснить, что функциональный сигнал ядерной локализации действительно имеется у белка VirD2 который присоединен к 5’ концу T-цепи, и исследования с мутантами показали, что он действительно активен в направлении T-комплекса в ядро клетки хозяина. Однако VirD2 – не единственный посредник ядерного поглощения T-комплекса. Впоследствии была показана ядерная локализация VirE2, главного структурного компонента T-комплекса. У этого белка были идентифицированы два функциональных NLS. Хотя каждый из сигналов ядерной локализации белка VirE2 был независимо активным, максимально эффективный ядерный импорт VirE2 требовал присутствия обоих сигналов.
У эукариотических организмов, распознавание сигнала ядерной локализации белка происходит через взаимодействие NLS с клеточными рецепторами, обычно принадлежащими к семейству белков кариоферинов. Введенный в клетку животных белок VirD2 быстро оказывался в ядре; таким образом, сигнал ядерной локализации этого белка является функциональным и в клетках растений, и в клетках животных. В отличие от VirD2, веденный в клетки животных VirE2 оставался в цитоплазме; таким образом, сигналы ядерной локализации этого белка не распознаются в системе животных и поэтому являются специфическими для растений. Таким образом, возможно, что клетки растения имеют набор рецепторов NLS, которые отсутствуют в клетках животных.
Ядерный импорт T-комплекса Agrobacterium достигает кульминации при интеграции транспортированной T-цепи в хромосому клетки растения-хозяина. Молекулярные механизмы, которыми это достигается, в значительной степени неизвестны. В отличие от других мобильных элементов ДНК типа транспозонов и ретровирусов, T-ДНК не кодирует никаких ферментов, которые могут обусловить интеграцию. Таким образом, вставка T-ДНК в геном растения должна опосредоваться белками, транспортированными из инфицирующей бактерии и/или факторами клетки хозяина.
В сравнительно недавних исследованиях было установлено, что оба связанных с T-цепью белка, и VirD2 и VirE2, не только направляют Т-ДНК в ядро, но и вовлечены в процесс интеграции. Т-ДНК является одноцепочечной, и вначале предполагалось, что интеграция предшествует синтезу второй цепи, который может выполнятся механизмами репарации ДНК клетки растения после интеграции T-цепи. Однако более поздние исследования особенностей интеграции T-ДНК привели к предложению, что T-цепи конвертируются в двухцепочечную форму перед интеграцией.
Изучение процесса интеграции Т-ДНК в геном растения позволил получить предположительный ответ на вопрос, почему Agrobacterium поражает только двудольные растения. Оказалось, что в основе устойчивости кукурузы и возможно других однодольных растений к заражению Agrobacterium лежит блокирование интеграции T-ДНК.
Анатомо-морфологические особенности растений
Габитус растений. Сорта картофеля, имеющие раскидистую ботву, менее поражаются фитофторозом, чем сорта с плотными кустами, хотя при искусственном заражении листьев в лаборатории никакой связи между габитусом куста и поражаемостью нет. Различия объясняются тем, что капли, необходимые для заражения, на листьях раскидистых сортов быстрее высыхают, чем у сортов с плотным кустами. Короткостебельные сорта пшеницы подвержены сильному поражению грибами, вызывающими пятнистости листьев, споры которых распространяются водяными брызгами (септориоз, ринхоспориоз др.), ибо расстояние между листьями (длина междоузлий) у таких сортов уменьшено. Сорта с опущенными вниз листьями, покрытыми к тому же густым восковым налетом, менее подвержены поражению ржавчиной, мучнистой росой, пятнистостями листьев, чем сорта с горизонтально расположенными или приподнятыми вверх листьями, ибо инфекционные капли в первом случае скатываются с листьев.
Опушенность листьев. Сорта малины с опушенными листьями меньше подвержены вирусным болезням, чем сорта с гладкими листьями. Это обусловлено затрудненными условиями для питания тлей-переносчиков вирусов.
Строение и расположение устьиц. Мандарин более устойчив к поражению возбудителем бактериального рака Xanthomonas citri, чем грейпфрут. Различия обусловлены тем, что наружные стенки устьиц мандарина снабжены выступами, препятствующими проникновению в подустичную щель капель жидкости с находящимся в них клетками бактерий. У восприимчивых сортов грейпфрута таких выступов нет. Виды и сорта растений с более редким расположением устьиц на листьях, слабее поражаются грибами, гифы которых внедряются через устьица (например, дикариотичные стадии возбудителей злаковых ржавчин).
Регуляция онтогенеза и репарации повреждений. Возбудители многих болезней, таких как твердая головня пшеницы, корневые гнили всходов и др., поражают растения только на ранних этапах их развития; другие — возбудители фитофтороза картофеля, вертициллезного вилта хлопчатника и др., наоборот, стареющие ткани, в которых отток и распад углеводов преобладает над фотосинтезом. Поэтому сорта, у которых быстро протекают ранние фазы онтогенеза, слабо поражаются болезнями первой группы, а сорта, у которых замедлено наступление старения, относительно устойчивы к болезням второй группы. На этом основаны также агротехнические приемы защиты растений с помощью регуляции скорости протекания отдельных фаз онтогенеза (высев озимых злаков в ранние сроки, а яровых — в поздние для получения дружных, быстро растущих всходов, задержка старения азотными удобрениями др.).
Многие паразиты растений могут внедряться в ткани только через ранки (раневые паразиты). Скорость суберинизации раневых поверхностей коррелирует с устойчивостью к подобным паразитам. Поэтому помещения, предназначенные для длительного хранения овощей и картофеля, снабжены устройствами, обеспечивающими продув воздуха с определенной температурой и влажностью через слой хранящейся продукции (активное вентилирование), ибо образование суберина требует больших энергетических затрат.
Пищевая ценность зараженных органов и тканей. Хотя растения представляют для паразитов, прежде всего, питательный субстрат, пищевые достоинства, по-видимому, не являются решающими в поражаемости тех или иных видов и сортов. Поскольку отмершие растения или их части заселяются микроорганизмам, неспособными заражать те же растения в живом состоянии, устойчивость растений обусловлена не содержанием тех или иных питательных веществ, а антибиотическими свойствами живой ткани. Однако, в некоторых случаях именно пищевые достоинства обусловливают степень восприимчивости растений к тем или иным болезням. Были проведены исследования для установления связи между содержанием в растениях азотсодержащего соединения холина и его эфира бетаина и поражаемостью Fusarium graminearum. Сильное поражение цветков злаков обусловлено высоким содержанием холина и бетаина в пыльниках.
Химические антимикробные вещества (фитоантиципины). Химические факторы, с помощью которых растения защищают себя от болезней, многообразны по химическому составу, условиям образования и механизмам токсичности.
В 1928 г. российский зоолог Б.П. Токин обнаружил токсичность для Protozoa летучих соединений из гомогенатов лука и чеснока. Токсические летучие соединения из растений он назвал фитонцидами. В 1941 г. немецкий фитопатолог К. Мюллер обнаружил, что в ответ на заражение картофеля авирулентной расой Phytophthora infestans в ткани клубня накапливаются токсические вещества, названные им фитоалексинами. Используя эти термины, Л.В. Метлицкий и О.Л. Озерецковская (1975) предложили все (а не только летучие) антибиотические вещества растений, образующиеся конститутивно, независимо от заражения, называть фитонцидами, а соединения, синтез которых индуцируется заражением — фитоалексинами. В дальнейшем предлагались более сложные классификации. Однако в 1994 г. группа исследователей (Г. Ван Эттен, Дж. Мансфилд и др.) предложили вернуться к двум группам растительных антибиотиков, которые они назвали фитоантщипинами и фитоалексинами. Первые — «низкомолекулярные антимикробные вещества, присутствующие в растении до заражения или продуцируемые после заражения из предшественников», вторые — «низкомолекулярные антимикробные вещества, которые синтезируются и аккумулируются в растении после экспозиции с паразитом». Синтез фитоалексинов происходит в процессе активной реакции растений, то есть относится к факторам активного иммунитета, и будет рассмотрен ниже.
Разделение антимикробных веществ растений на фитоантиципины и фитоалексины отчасти условно, как условно большинство биологических классификаций. Например, некоторые вещества в одних видах растений конститутивные, т.е. являются фитоантиципинами, а в других — индуцируются заражением (фитоалексины).
Химическая классификация фитоантиципинов
Фенолы. К фенолам относят циклические соединения, содержащие ароматическое кольцо с фенильным гидроксилом или его замещенными радикалами (кислотным, альдегидным и проч.). Многие растительные фенолы помимо фенила (С6) содержат пропановый радикал (С3) и названы фенпппропаноидами.
Исследование растительных фенолов хорошо иллюстрирует условность деления антибиотических веществ на конституционные и индуцибельные. Фенолы — нормальные метаболиты растений, ибо входят в состав пигментов, регуляторов роста, структурных элементов клеточных стенок. В то же время фенолы — стрессовые метаболиты, синтез которых резко возрастает при поранении или заражении.
Окислительно-восстановительная реакция превращения фенолов в общем виде описывается следующим образом:
полифенолоксидаза |
½О2 + дифенол ↔ хинон + Н2О |
хинонредуктаза |
Основные механизмы антимикробного действия фенолов:
1. Инактивация белков вследствие соединения хинонов с SH-, NH2 группами и формирования замещенных продуктов.
2. Неспецифическое окислительное действие хинонов. Будучи активными окислителями, хиноны являются акцепторами электронов у многих соединений.
3. Влияние на трансмембранный транспорт веществ. Некоторые замещенные фенолы служат проводниками протонов в мембранах и в следствие этого действуют как разобщающие агенты.
4. Создание химических барьеров. Продукты окисления фенольных спиртов, конденсированные в результате свободнорадикальных реакций, образуют аморфный 3-мерный полимер лигнин, откладывающийся в клеточных стенках (обычно во вторичных стенках и стенках мертвых клеток). Защитное действие лигнина многообразно. Он ковалентно связывается с углеводными полимерами растительной клеточной стенки и защищает их от атаки грибными деполимеразами; препятствует диффузии в клетки растений метаболитов патогенных организмов; обладает прямой токсичностью для микроорганизмов; может лигнифицировать внутрирастительные гифы грибов.
Терпеноиды. К терпеноидам относят соединения, синтезируемые из уксусной кислоты путем конденсации ее молекул. Первый продукт конденсации — изопрен — содержит 5 атомов углерода. В построении терпеноидов участвуют 2 группы ферментов — полимеразы, соединяющие молекулы изопрена в цепочку, и циклазы, осуществляющие преобразование цепочек в замкнутые кольца.
Конденсация двух молекул изопрена дает группу соединений, названных монотерпенами. Эти низкомолекулярные моноциклические летучие вещества часто придают растениям специфические запахи. Конденсация трех молекул изопрена приводит к образованиюсесквитерпенов (С15). Многие бициклические сесквитерпены обладают высокой токсичностью и являются важными факторами устойчивости растений. 4 молекулы изопрена составляют дитерпены (С20) — основные компоненты смол древесных растений. Многие дитерпены горькие на вкус (например,горький фактор огурца).
6 молекул изопрена составляют основу большой группы тритерпенов (C30). К ним относятся пентациклические тритерпеноиды (5 шестичленных циклов) и стероиды, ядро которых состоит из трех шестичленных циклов и одного пятичленного. Фитостерины — необходимый компонент растительных мембран, а эргостерин — мембран многих грибов. Токсичность многих тритерпеноидов обусловлена их способностью связываться со стеринами мембран; в результате чего образуются поры в мембранах, и происходит потеря клеточного содержимого в окружающую среду (лизис).
Наконец соединение восьми молекул изопрена дает многочисленный класс тетратерпеноидов (С40). Их линейные молекулы образуют большую группу растительных пигментов каротиноидов, которые окрашивают цветки, плоды, корнеплоды, осенние листья растений.
Белки, аминокислоты. Факторами устойчивости растений к патогенам могут быть семейства низкомолекулярных, основных, богатых цистеином белков, включающих растительные дефензины, белки, осуществляющие трансмембранный транспорт липидов, белки, подавляющие синтез белка чужеродными рибосомами на стадии элонгациии, и тионины, накапливающиеся в семенах и проростках многих растений. Их антимикробное действие продемонстрировано многими опытами. Они обнаружены в семенах, листьях, цветках и клубнях. Большинство этих белков накапливаются в клеточных стенках или даже на поверхности семян, осуществляя функции первой линии обороны.
В семенах некоторых бобовых обнаружена необычная аминокислота l-канаванин, содержание которой может достигать 2—3% сухого веса семян. Будучи антиметаболитом аргинина, она высокотоксичная и защищает семена от повреждения грибами и насекомыми.
Стратегия устойчивости.Растения обладают не только химическим разнообразием защитных соединений, но и разнообразными стратегиями их применения. Используя военную терминологию, можно сказать, что растения имеют глубоко эшелонированную оборону с гибким управлением, способным создавать в нужном месте и в нужное время разнообразные защитные барьеры на пути продвижения паразита.
Антимикробные вещества растительных покровов
Многие органы растений, — клубни, луковицы, стволы древесных пород покрыты слоем мертвых клеток. Отмирание клеток, как и их механическое повреждение, приводит к разрушению внутриклеточных мембран и совмещению химических соединений, разобщенных в живой клетке мембранам. В результате этого протекают химические реакции и накапливаются высокотоксичные соединения. Их накопление в живых клетках могло бы привести к повреждениям последних, но в мертвых — они играют роль химического барьера на пути движения паразитов. Например, желтая окраска чешуи лука обусловлена находящимся в вакуолях флавоновым пигментом кверцитрином, который представляет собой сложный фенол квертецин, соединенный гликозидной связью с моносахаридом рамнозой. В отмирающих кроющих чешуях луковицы вследствие разрушения вакуолей происходит серия химических реакций: сначала фермент глюкозидаза отщепляет сахарный остаток, затем фенолоксидазы расщепляют квертецин до низкомолекулярных водорастворимых монофенолов — протокатеховой кислоты и о-катехола, которые высоко токсичны для микроорганизмов.
|
|
|
|
|
|
Фенольный агликон лука квертицин и продукты его распада — протокатеховая кислота и о-катехол (слева направо).
Диффундируя на поверхность в инфекционную каплю, они убивают споры фитопатогенных грибов. Поэтому окрашенные сорта лука устойчивы к грибам, вызывающим гнили луковиц. Луковицы с поврежденными кроющими чешуями поражаются независимо от наличия окраски, ибо в живых клетках простые фенолы не накапливаются.
В мертвых клетках коры многих деревьев присутствует токсичный для микроорганизмов дифенол пиносильвин, в клетках коры ильмов — фактор устойчивости к голландской болезни сесквитерпен мазонон.

Пиносильвин
Антимикробные вещества живых клеток
Большинство токсических веществ находится в живых клетках в форме гликозидов, которые, во-первых, менее токсичных, чем их агликоны и, поэтому не опасны для клеточного метаболизма, и, во-вторых, водорастворимы и поэтому являются транспортной формой токсинов. Обычно они находятся в вакуолях и отделены тонопластом от других компонентов клетки, что также защищает ее от повреждающего действия. При повреждении клеточных мембран содержимое вакуолей выливается в клетку и гликозиды входят в контакт с ферментами гликозидазами, находящимися в других мембранных пузырьках лизосомах, или ковалентно связанными с компонентами клеточной стенки. В результате химических реакций освобождаются высоко токсичные агликоны, убивающие клетку и находящихся в ней паразитов. Такова генеральная стратегия защиты от заражения и иных стрессов. Частный случай такой защиты — рассмотренное освобождение агликонов в естественно отмирающих кроющих клетках.
Классифкация гликозидов основывается на химическом строении агликонов.
Фенольные гликозиды. Выше рассмотрены реакции превращения фенольного гликозида кверцитрина в кроющих чешуях окрашенных луковиц. У различных видов злаков (ржи, пшеницы, кукурузы) содержится семейство глюкозидов бензоксазинов, агликон которых содержит наряду с фенолом азотсодержащий цикл. В поврежденных клетках освобождаются агликоны бензоксазолиноны, токсичные для ржавчинных грибов, возбудителей снежной плесени, тлей и других насекомых. По-видимому, эти соединения являются важным фактором неспецифической устойчивости. Например, корреляция между их содержанием в листьях инбредных линий кукурузы и поражаемостью этих линий листовой тлей составила -0,72.
Цианогенные гликозиды. Многие растения (сорго, лядвенец, просо, лен и др.) содержат цианогенные гликозиды (дурринин, линамарин, лотаустролин), которые образуются в процессе прорастания семян из аминокислот (тирозина и др.). Ферменты, осуществляющие поэтапное превращение аминокислоты в цианогенный глюкозид, находятся на внутриклеточных мембранах в виде комплекса, эффективно канализующего поток углерода из l-тирозина в гликозид.
Гликозиды алифатических соединений. В луковицах тюльпанов накапливается гликозид тюлипозид, который после отщепления сахара замыкается в лактонный цикл, очень токсичный вследствие высокой реакционной способности (связывается по месту двойной связи с SH-группами белков). Реакция образования лактона — важный фактор устойчивости тюльпанов к Botrytis cinerea.
Терпеноидные гликозиды и гликоалкалоиды. Тритерпеноиды и стероиды образуют с сахарами гликозиды, мылящиеся в воде, и названные сапонинами (от латинского sapo — мыло). У большинства сапонинов олигосахаридная цепь прикреплена к терпеноидному ядру в положении С-3, хотя у многих имеется дополнительная связь с глюкозой в положениях С-26 или С-28. Сапонины очень ядовиты, так как связываются со стеринами в мембранах. Накапливающийся в корешках овса тритерпеноидный гликозид авенацин является фактором устойчивости к корневой гнили, вызываемой грибом Gaeumannomyces graminis. Стероидные гликозиды пасленовых имеют в своем составе азотсодержащий гетероцикл и названы гликоалкалоидами. Синтез гликоалкалоидов картофеля соланина и чаконина индуцируется освещением, поэтому они накапливаются в листьях, ягодах (обусловливают их горький вкус) и озелененных на свету клубнях, которые становятся ядовитыми, но хорошо хранятся, не повреждаясь гнилями. Соланин и чаконин подавляют рост фитопатогенных грибов in vitro и является фактором возрастной устойчивости картофеля.
Гликоалкалоид томатов томатин накапливается в вакуолях листьев и зеленых плодов томатов. Он высоко токсичен для Cladospohum fulvum и других грибов (вызывает потерю электролитов через мембраны). Гликоалкалоид дикого картофеля Solarium demissum демиссин является репелентом для колорадского жука.
Тиогликозиды. До сих пор рассматривались соединения, связь которых с сахаром осуществлялась через кислород. У растений из семейств капустных и каперцовые накапливаются соединения, агликон которых связан с сахаром через атом серы. Их называют горчичными маслами, тиогликозидами или гликозинолатами. Депо гликозинолатов — вакуоль.
При повреждении тонопласта они приходят в контакт с специфическими ферментами, которые отщепляют сахар. В результате образуется продукт, содержащий изородановую группу R-N=C=S —летучее, высокотоксичное соединение, действующее на слизистые оболочки и имеющее высокий антимикробный эффект. Его слезоточивое действие ощущается, например, при натирании корня хрена.
Резюмируя сказанное, видно, что система клеточной защиты, основанной на освобождении токсических веществ из гликозидов, высокоэффективна и универсальна. Однако многие фитопатогенные организмы в процессе коэволюции с растенями выработали механизмы, нейтрализующие эту систему.
Такие механизмы можно свести к следующим:
1. Мягкое, не повреждающее мембраны воздействие на клетки растений.
2. Изменение чувствительного к токсину сайта. У гриба Stemphilium loti, вызывающего пятнистость листьев цианогенного лядвенца, высокий вклад в дыхание приходится на альтернативный, нечувствительный к цианиду путь.
3. Модификация токсических веществ до менее токсичных. Этот механизм патогенности широко распространен в мире фитопатогенов.
Продуцирование видов реактивного кислорода и оксида азота (окислительная вспышка)
Продуцирование видов реактивного кислорода, вероятно, играет ключевую роль в защите растений. Часто это является первым откликом, активируемым при многих несовместимых взаимодействиях. Doke и соавторы (1983, 1988) были первыми, кто сообщил, что супероксидные анионы (O2∙ ─) продуцируются при несовместимых взаимодействиях, первоначально между картофелем и Phytophthora infestas, а затем между табаком и вирусом табачной мозаики. Генерируемый O2∙ ─ быстро дисмутирует либо неферментативно, либо через катализируемую супероксиддисмутазой реакцию до перекиси водорода HO2∙ + O2∙ ─ + Н+ ↔ Н2О2 + О2 либо 2O2∙ ─ + 2Н+ ↔ Н2О2 + О2, и таким образом у большинства растительных систем обнаруживается накопление H2О2. При кислом рН, таком, который наблюдается в клеточной стенке растения, период полужизни супероксида составляет <1 секунды. Поскольку H2О2 не имеет неспаренного электрона, она может пересекать биологические мембраны, что заряженные виды O2∙ ─ могут делать очень медленно. Как O2∙ ─, так и H2О2 имеют промежуточную степень реакционной способности, и клеточные повреждения, вызываемые реактивными видами кислорода (ROS) по-видимому обусловлены их превращением в более реактивные виды. Протонирование O2∙ ─, которое происходит более легко при низком рН, дает гидропероксильный радикал HO2∙. Поскольку HO2∙ является менее полярным, чем O2∙ ─, он может пересекать биологические мембраны примерно так же эффективно, как и H2О2. В отличие от O2, HO2∙ может непосредственно атаковать жирные кислоты, и, как показано, превращает линоленовую, линолевую и арахидоновую кислоты в перекиси липидов. Таким образом, при подходящих условиях, генерация O2∙ ─, приводящая к образованию HO2∙, может приводить к повреждению мембран и образованию массива потенциальных сигнальных молекул перекисей липидов.
В присутствии Fe2+, H2О2 может претерпевать реакцию Фентона {Fenton reaction}, которая приводит к появлению крайне деструктивного гидроксильного свободного радикала OH∙:
Fe3+ + O2∙ ─ → Fe2+ + O2 ;Fe2+ + H2О2 → OH∙ + OH– + O2
который может инициировать самопроизвольное перекисное окисление липидов. Если H2О2, входящая в цитоплазму клетки, сохраняется в достаточно высокой концентрации, чтобы достичь ядра растения или патогена, она может реагировать с внутриклеточными ионами металлов, образуя OH∙, который, как известно, фрагментирует ДНК сайт-специфической атакой. Таким образом, продуцирование ROS может приводить к значительному повреждению как хозяина, так и патогена и заставляет растительные клетки активировать массивы защитных механизмов.
В относительно недавних исследованиях с использованием культуры клеток растений было показано, что растения, вероятно, имеют механизм продуцирования O2∙ ─, в котором принимает участие NADPH-оксидаза, аналогичная той, которую используют нейтрофилы млекопитающих.
Однако клетки растений имеют еще два других пути генерации ROS. Во-первых, это белок оксалатоксидаза, которая может продуцировать H2О2 из щавелевой кислоты. Во-вторых, H2О2 могут продуцировать пероксидазы клеточной стенки.
Для ROS предполагается несколько ролей в защите растения. Например, H2О2 может непосредственно быть токсичной для микробов на уровнях, которые продуцируются в растениях. H2О2 также может вносить вклад в структурное упрочнение клеточных стенок растения; H2О2 необходима для образования предшественников лигниновых полимеров посредством активности пероксидазы и было показано, что обогащенные гидроксипролином и пролином гликопротеины клеточной стенки быстро окислительно сшивались в клеточных стенках после обработки грибным элиситором. Это поперечное сшивание белков также снижает «доступность протопласта», таким образом делает клеточную стенку растения более устойчивой к микробному проникновению и ферментативной деградации.
Также вероятна сигнальная роль для H2О2. H2О2 повышает ферментативную активность гидрокислазы бензойной кислоты, которая необходима для биосинтеза салициловой кислоты (SA). Кроме того, H2О2 активирует некоторые защитные механизмы, например, экспрессию гена глутатион-S-трансферазы, в смежных клетках.
Вероятно, генерация ROS будет приводить к изменению окислительно-восстановительного баланса в реагирующей клетке. У млекопитающих, многие факторы транскрипции, такие как ROS-отзывчивый фактор NF-kB, как известно, регулируются окислительно-восстановительным состоянием. Подобное может происходить и у растений. Имеются данные, которые наводят на мысль, что O2∙ ─ может быть одним из сигналов, который координирует индукцию генов защиты растения.
Оксид азота привлек значительный интерес фитопатологов благодаря установленной его роли в регуляции антимикробной защиты у млекопитающих, в частности через программируемую клеточную гибель (PCD).
NO действует как сигнальная молекула у видов всех биологических царств, эта особенность обусловлена его физическими свойствами, которые обеспечивают ему исключительно богатую химическую активность. NO высоко реактивный, благодаря присутствию неспаренного электрона, и подобно кислороду, он может существовать в виде ряда восстановленных состояний, –NO (нитроксильный ион, nitroxyl ion), NO и +NO (ион нитрозония, nitrosonium ion), и в каждом из них реактивные промежуточные соединения азота (reactive nitrogen intermediate (RNI)) способны осущетсвлять специфические взаимодействия. ·NO способен реагировать с атмосферным O2 с образованием NO2. Далее, NO является замечательно мобильной молекулой, способной легко пересекать мембраны, и, поскольку он мало растворим в водных растворах, он легко переходит в газообразную фазу. Это заметно повышает его потенциал как сигнальной молекулы.
В биологических системах, NO вмешивается в пути передачи сигналов посредством целого ряда действий. Многие эффекты NO обусловлены окислительным повреждением, связанным с образованием потенциального оксиданта пероксинитрата через взаимодействие с суперокисидом (NO + O2– → –ONOO). Менее жестким действием является электрофильная атака со стороны ·NO тиоловых групп, в частности остатков цистеина, что приводит к S-нитрозилированию молекул, таких как глутатион или белки. S-нитрозилирование может модулировать активность белка; например, мономерной связывающий GTP белок, p21ras, активируется S-нитрозилированием, тогда как, в противоположность этому, киназа JNK1 при этом инактивируется.
Альтернативно NO может модифицировать белки посредством нитрирования, в частности остатков тирозина. Сродство NO к переходным металлам (например Fe2+/Fe3+), приводит к формированию комплексов железо-нитрозил; такое взаимодействие также используется для регуляции биологической активности. Это взаимодействие является центральным в классическом пути передачи сигналов, в котором NO связывается с группами гема растворимой и ассоциированной с мембраной гуанилилциклазы, что приводит к изменению конфигурации и активации энзиматической продукции cGMP из GTP. Увеличение уровня cGMP повышает активность киназы (NO-G-kinase) и фосфодиэстразы, которые влияют на регуляцию cGMP ионных каналов. Одной из хорошо документированных целей NO-G-киназы является легкая цепь миозина.
Другое важное взаимодействие включает связывание NO с группами гема в пределах ферментов P450, и это ингибирует их активность. Особенно интересным является взаимодействие NO с гемоглобином (Hb), поскольку этот комплекс имеет способность доставлять, запасать и окислять (детоксифицированть) NO. Гемоглобины растений, как было показано, реагируют с NO с образованием NO3 при аэробных условиях в двустадийном процессе. На первой стадии, NO окисляет гем с образованием метагемоглобина, из которого NO3 высвобождается после восстановления редуктазой, содержащей NADPH или флавин. Этот путь представляет механизм, посредством которого уровни NO быстро изменяются в биологических системах.
NO/пероксинитрит может также обратимо нарушать активность ферментов, содержащих в активном центре железо и серу (4Fe-4S), что приводит к потере железа ([4Fe-4S]2++ONOO– + H+ → [3Fe-4S]+ + NO– + ·NO2 + Fe2+), которая затрагивает энзиматическую активность. Хорошо охарактеризованными целями в подобном случае является фермент цикла Кребса аконитаза, которая катализирует изомеризацию цитрата в изоцитрат, и комплексы I и II в электрон-транспортной цепи. Таким образом, взаимодействие NO/белок 4Fe-4S будет усиливать окислительный стресс посредством нарушения функций митохондрий и посредством способствованию образованию реактивного гидроксильного радикала через реакцию Фентона (Fe2+ + H2O2 → Fe3+ + HO– + ·HO).
В биологических системах, NO может генерироваться ферментативным путем и неферментативно. Наиболее хорошо описанными ферментами, продуцирующими NO, явлюется синтаза оксида азота (NOS) и нитратредуктаза (NR). NOS катализирует двухстадийное окисление L-аргинина в NO и цитруллин (L-аргинин + NADPH2 + O2 → Nω-гидроксиаргинин → + NADPH2 + O2 → L-цитруллин + NO); данная реакция может также катализироваться цитохромом P450. NR генерирует NO из нитрита с использованием NADPH в качестве донора электронов.
Несмотря на идентификацию гена NOS растений, очевидные доказательства показывают, что растения могут продуцировать ·NO из нитрита с помощью NADPH-зависимой нитратредуктазы (NO3 → NO2 → ·NO + O2). Использование высоких уровней нитратов при условиях аноксии увеличивает продуцирование NO. Также допускается, что NO у растений может образовываться посредством неферментативного восстановления нитрита (2NO2 + 2H+ ↔ 2HNO2 → NO + NO2 + H2O), этой реакции благоприятствуют кислые условия, подобные тем, которые обнаруживаются в апопласте алейронового слоя ячменя.
Укрепление клеточных стенок
Микробы должны преодолеть кутикулу растения и/или клеточную стенку для того, чтобы достигнуть клетки, хотя проникновение может иногда происходить через повреждения или естественные отверстия. Укрепление клеточной стенки растения может повысить устойчивость несколькими путями. Для внеклеточных биотрофов, таких как Pseudomonas syringae или Cladosporium fulvum, уплотнение клеточных стенок может затруднять утечку цитоплазматического содержимого, таким образом снижая доступность питательных веществ для патогена. Для некротрофов, таких как Botrytis cinerea, которые зависят от гидролиза клеточных стенок растения для продвижения растущих гиф, диффузия токсинов и ферментов к чувствительным клеткам растений будет замедлена. Кроме того, низкомолекулярные фенольные предшественники лигнина и свободные радикалы, образующиеся в течение реакций полимеризации в клеточных стенках растений, могут нарушать пластичность мембран патогена или инактивировать токсины и ферменты. Сами гифы также могут стать лигнифицированными. Для гаусториальных биотрофов, предотвращение входа гриба в клетку растения будет предотвращать паразитизм.
Одним из типов укрепления стенки, который быстро протекает в ответ на внедрение гриба, является формирование папилл. Папиллы часто образуются под гифой проникновения и являются гетерогенными по составу; они, как считается, физически блокируют проникновение гриба в клетку хозяина.
Быстрое отложение каллозы в клеточных стенках также часто ассоциировано с сайтом несовместимости с патогенном. Блокировка плазмодесм каллозой является существенным компонентом защиты, необходимым для задержки движения вирусов из клетки в клетку.
Основные обогащенные гидроксипролином белки, как считают, играют ключевую роль в организации архитектуры первичной клеточной стенки и могут действовать как очаги инициации полимеризации лигнина. Быстрое окислительное поперечное сшивание сформированных заранее HRGPs через или меж- или внутримолекулярные изодитирозиновые связи может представлять один из наиболее ранних защитных откликов, сопровождающих окислительную вспышку.
Дополнительным, но более слабым механизмом, который помогает становиться клеточным стенкам более непроницаемыми, является локальное повышение в них содержания лигнина.
Перепрограммирование транскрипции и синтез PR белков и других связанных с защитой белков
Термин «связанные с патогенезом белки» (PR белки) был первоначально использован для описания многочисленных внеклеточных белков, которые накапливаются в ответ на заражение ВТМ восприимчивых генотипов табака. Впоследствии, при ряде взаимодействий растение–патоген, дифференциальная индукция генов PR была найдена в ассоциации с несовместимостью. Недавно определение PR белки было расширено и включает локализованные внутри- и внеклеточно белки, которые накапливаются в интактных растительных тканях или культурах клеток после атаки патогенов или обработки элиситорами.
Играют ли PR белки причинную роль в устойчивости? Несколько PR белков обладают либо антигрибной, либо антибактериальной активностью in vitro и, как сейчас известно, являются хитиназами, или глюканазами, или связывают хитин. Деградация структурных полисахаридов клеточной стенки гриба, или нарушение архитектуры клеточной стенки, могут задерживать или сильно ослаблять рост грибов. Более того, конститутивная экспрессия PR белков с известной или неизвестной функцией в трансгенных растениях приводит к повышенной устойчивости к некоторым грибным патогенам. Ряд данных наводят на мысль, что для проявления устойчивости требуется координированная активность нескольких генов PR.
Основные обогащенные цистеином (тионины), выявляемые главным образом в злаках, являются другой группой связанных с защитой белков с известной антимикробной активностью. Подобно PR белкам, эти тионины также дифференцированно накапливаются в течение несовместимых взаимодействий.
Синтез фитоалексинов
Честь открытия фитоалексинов (ФА) принадлежит немецким фитопатологам Мюллеру и Боргеру. Долгое время ФА рассматривались как главный механизм устойчивости растений. Однако в настоящий период помимо ФА в растениях обнаружены и другие иммунные ответы. Конечно, ФА не утеряли свою значимость, однако их уже следует рассматривать на фоне мультикомпонентного ответа растительной клетки.
К настоящему времени охарактеризовано около 350 ФА у растений из 30 семейств. Их большая часть принадлежит к семейству бобовых (около 130 ФА). Основное число ФА выделено из двудольных растений, но охарактеризованы и некоторые ФА однодольных, в частности у риса, кукурузы, сорго, ячменя, овса, пшеницы, лука и лилий. ФА являются липофильными соединениями, локализованными вокруг места инфекции. Из-за разнообразия их структуры трудно судить о единых механизмах их антимикробной активности.
Фенилпропаноидные ФА приурочены к растениям семейства бобовых, пасленовых, вьюнковых, зонтичных и злаковых. Известна некоторая структурная специфичность ФА, отражающая таксономическое положение их продуцентов. Так, изофлавоноидные ФА, в основном, сосредоточены в растениях семейства бобовых, но их нет у пасленовых, и наоборот, сесквитерпеноидные ФА присущи пасленовым, но не обнаруживаются у бобовых.
Образование ФА тесно связано с реакцией сверхчувствительности (СВЧ). Мертвые (некротизированные) клетки, образующиеся в результате реакции СВЧ, играют особую функциональную роль в явлении устойчивости, поскольку они являются резервуарами для накопления ФА. Сами по себе мертвые клетки вряд ли могут остановить развитие патогена, но они являются местом складирования или вместилища ФА. Поэтому, чтобы судить о защитной роли ФА в качестве антигрибного барьера на пути распространения инфекции, надо рассчитывать их количество не на единицу веса инфицированной ткани, где присутствуют как живые, так и погибшие клетки, а на их концентрацию в некротизированных клетках. В таких клетках ФА накапливаются в чрезвычайно высоких антигрибных концентрациях, которые вряд ли могут выдержать живые растительные клетки.
Что заставляет перемещаться ФА из живых клеток, где они или их близкие предшественники образуются, в мёртвые, некротизированные, где они накапливаются, не известно. Возможно, накопление ФА в некротизированных клетках определяется еще и тем, что системы деградации ФА в таких клетках подавлены. Иными словами присутствие ФА в мертвых клетках как бы саморегулируется, поскольку ФА в некрозе инактивируют систему их собственной деградаций, тем самым, способствуя их накоплению.
ФА являются достаточно слабыми антигрибными агентами. Доказательств их передвижения в растениях не существует. Однако скорость накопления ФА и их локализация в месте инфекции способствует поддержанию в растении токсичной для грибов концентрации. Исход взаимоотношений растения и паразита зависит от двух факторов: от количества образовавшегося ФА и от чувствительности к нему патогена.
Хотя большинство растений продуцируют ФА, существуют виды (огурцы, дыни и арбузы), образование ФА в которых не установлено, хотя есть все основания предполагать их присутствие.
Синтез салициловой кислоты
Несовместимые патогены часто вызывают накопление салициловой кислоты (SA). Она может оказывать непосредственное антимикробное действие. Однако наиболее важная роль салициловой кислоты состоит в координировании экспрессии PR генов и других генов защиты через специфические зависимые от салициловой кислоты сигнальные пути. Абсолютная потребность в SA показана при обусловленной генами устойчивости к различным вирусам, бактериям и грибам. Кроме того, салициловая кислота считается
Глушение генов (gene silencing)
В течение длительного времени была распространена точка зрения, что зараженное вирусами восприимчивое растение не может выздороветь. На устойчивом растении симптомы заболевания могут ослабеть или исчезнуть, но восприимчивое растение не может стать снова здоровым. Однако недавно выздоровление было получено в некоторых комбинациях восприимчивое растение/вирус. Первоначально зараженное вирусом растение выявляло типичные симптомы, вирус распространялся системно, однако вновь образовавшиеся части растения не имели ни симптомов заболевания, ни вирусных частиц. При этом выздоровевшие бессимптомные и безвирусные части растения также проявили устойчивость к последующему заражению вирусом, показывая формирование приобретенной устойчивости. Этот тип устойчивости растений может быть обусловлен особой формы подавления активности генов.
Большое значение подавления генной активности имеет у трансгенных культур, в которых внедренный ген экспрессировался неэффективно. В большинстве случаев «заглушенный ген» в трансгенных растениях транскрибировался, однако матричная РНК разрушалась. Это явление было названо посттранскрипционным глушением генов. Интересно, что в дополнение к глушению внедренного гена, эндогенные гомологичные гены трансгенных растений также были заглушены. В селекции растений глушение генов является нежелательным механизмом.
Глушение генов является специфическим механизмом, действующий только на гомологичные последовательности нуклеиновых кислот. Было показано, что даже определенные части вирусного генома, например ген белка оболочки или ген репликазы вируса, внедренные в растение, способны индуцировать устойчивость (глушение) по отношению к вирусной инфекции у этих трансгенных растений. Этот тип устойчивости эффективен только по отношению к тем штаммам вирусов, которые имеют гомологию к вирусу, который послужил источником трансгенных последовательностей.
Механизм глушения генов и устойчивости к вирусам объясняют с помощью модели порогового значения. Растения, возможно, распознают количество чужеродной трансгенной мРНК или вирусной РНК и, при определенном пороговом значении, инициируется деградация РНК. Первоначально повышается активность РНК-зависимой РНК-полимеразы и синтезируется цепь антисмысловой РНК, гомологичной трансгенной РНК или вирусной РНК. Это приводит к формированию двухцепочечной структуры РНК. Такая структура является чужеродной для растений, и растения ее разрушают с использованием нескольких рибонуклеаз. В общем, механизм глушения генов является сложным; например, некоторые вирусы растений кодируют супрессорные белки для системы глушения генов.
Реакция сверхчувствительности как форма апоптоза
Сверхчувствительность — это защитная реакция растения в ответ на заражение патогенами, проявляющаяся в быстрой локальной гибели клеток растения и сопровождающаяся накоплением в погибших клетках токсических продуктов. Растение как бы жертвует своей частью ради спасения целого. РС может быть фенотипически различной, варьируя от гибели отдельной клетки до распространения некротических зон, сопровождающегося ограниченной колонизацией патогена. Кроме этого, появление РС зависит от окружающих условий и в частности может ослабевать при условии высокой влажности. Вместе с клетками растения погибает внедрившийся патоген.
Клеточная смерть известна с момента открытия клетки. Мертвые клетки коры дуба были описаны первооткрывателем клетки Гуком в 1665 г. В XIX веке ученые описали смерть клеток как процесс. В XX веке были выделены две формы клеточной гибели у животных: апоптоз, или программируемая клеточная смерть, и некроз, или патологическая гибель клеток, сопровождающаяся воспалением. Это открытие сыграло важнейшую роль в развитии современных представлений о клеточной гибели и приблизило к пониманию конкретных механизмов гибели на клеточном уровне. В настоящее время программируемая клеточная гибель известна у широкого круга представителей разных систематических групп живых организмов: у животных, растений, грибов, микроорганизмов, включая прокариот. Апоптоз возник у прокариот, по всей видимости, как защита от вирусов или от повреждающего действия активных форм кислорода (АФК), т.е. как механизм выбраковки клеток с избыточной продукцией токсичных форм одноэлектронного восстановления кислорода. В ходе эволюции расширялись функции апоптоза. Гибель клеток имеет большое значение для эмбриогенеза, морфогенеза, дифференцировки, как отклик на неблагоприятные факторы среды, а также инструмент иммунного ответа. Широко известны примеры апоптоза у растений — развитие ксилемы, флоэмы, формообразование листьев, прорастание пыльцевой трубки (гибель клеток пестика на пути трубки),опадание листьев и созревание плодов. Исследования последних лет выявили много общего между апоптозом у животных и реакцией сверхчувствительности у растений.
Морфологические изменения клеток при апоптозе и некрозе
Типичные признаки апоптоза у животных — это конденсация и дробление ядра, разрыв нити ДНК на олигонуклеосомные фрагменты, которые образуют «ДНК-лесенку» при электрофорезе, формирование апоптозных телец — мембранных структур, содержащих фрагменты ДНК. При этом цитоплазматическая мембрана остается интактной до образования апоптозных телец. Клетка, претерпевающая апоптоз, резко уменьшается в объеме, протопласт съёживается, а мембрана приобретает складчатость. Далее разрыхляется хроматин. Наблюдается увеличение уровня ядерного гетерохроматина и перемещение его к краям ядра. Ядерная ДНК разрывается на фрагменты длиной приблизительно 50 тысяч пар оснований. В дальнейшем такие фрагменты под действием Са2+-зависимой эндонуклеазы разрываются на олигонуклеосомные фрагменты длиною около 180 пар оснований. Апоптозные тельца с фрагментами ДНК мигрируют из центра клетки к ее периферии.
Все признаки апоптоза у животных выявлены у растений при реакции сверхчувствительности. Разрезание ДНК на длинные фрагменты отмечалось при сверхчувствительном отклике растений в ответ на заражение вирусами, бактериями и грибами. В клетках зараженных растений при этом идентифицируются свободные З’-ОН концы, выявлена активация Са2+-за-висимой эндонуклеазы, обнаружены фрагменты ДНК длиной 50 тыс. пар оснований, а также олигонуклеосомные фрагменты, дающие характерную «ДНК-лесенку» при разгоне в агарозном геле. Для модельной системы томат – Alternaria alternata f.sp. lycopersici показано, что фрагментация ДНК с образованием олигонуклеосомных фрагментов происходит только в несовместимых комбинациях растение-патоген (то есть при воздействии авирулентных штаммов гриба, но не вирулентных). Кроме того, были обнаружены остаточные апоптозные тельца, мигрирующие к периферии клетки. У животных апоптозные везикулы поглощаются соседними или специализированными клетками, такими как макрофаги. У растений фагоцитозу препятствует клеточная стенка. При реакции сверхчувствительности плазмодесмы разрываются, а вокруг очага поражения образуется перидерма (вследствие приобретения здоровыми клетками меристематической активности). Поврежденная клеточная стенка либо полностью разрушается при участии гидролитических ферментов, действующих очень локально, либо укрепляется за счет целлюлозных утолщений, лигнификации, сшивки белков, отложения кремния. Упрочнение клеточной стенки замуровывает проникшего патогена внутри клетки и затрудняет проникновение новых патогенов.
Важную роль в программируемой гибели клеток как животных, так и растений играют митохондрии. Под воздействием индукторов апоптоза резко снижается мембранный потенциал митохондрий. Деполяризация обусловлено увеличением проницаемости внутренней мембраны митохондрий вследствие образования гигантских пор. Их диаметр позволяет пересекать мембрану веществам с молекулярной массой 1,5 кДа и ниже. Митохондриальный матрикс набухает. Это вызывает разрыв наружной мембраны митохондрий. Следствие разрыва — высвобождение белков межмембранного пространства митохондрий, что является важным этапом апоптоза. Хлоропласты растений также могут принимать участие в непосредственном регулировании программируемой гибели растительных клеток при реакции сверхчувствительности: предполагается участие хлоропластов как источников активных форм кислорода и координационного центра в гибели клеток растений при сверхчувствительном отклике. Высказываются предположения и о роли других мембранных структур, например мембраны вакуоли тонопласта, в запуске механизмов гибели растительных клеток.
При некрозе объем клетки значительно увеличивается. Изменяется проницаемость цитоплазматической и внутриклеточных мембран. Цитоплазма вакуолизируется. Повреждается тонопласт. Органеллы набухают и разрушаются. В дальнейшем мембраны разрываются, происходит дезинтеграция клетки. Остатки органелл лизируются. Содержимое клетки попадает в межклеточное пространство.
При некрозе не происходит активирования какой-либо генетической программы. Апоптоз, напротив,— результат запуска определенной генетической программы. Обнаружены многочисленные позитивные и негативные регуляторные гены апоптоза. Эти гены могут непосредственно активировать апоптоз через индукторы, блокировать через репрессоры, изменять метаболизм растений, влиять на сигнальные молекулы, их рецепторы или непосредственна на другие гены. Области гомологии между последовательностями регуляторных генов апоптоза у животных и растений редки. Это указывает на то, что либо у растений эволюционировали свои генетические механизмы регуляции программируемой клеточной гибели, либо дивергенция генов зашла так далеко, что они уже не идентифицируются как гомологичные.
Системная приобретенная устойчивость. Приобретенная устойчивость развивается в растениях после первичной инфекции; при этом окружающие ткани или отдаленные части растения становятся устойчивыми к последующему заражению. Этот тип устойчивости является неспецифическим; он эффективен по отношению к различным стрессам и повторному заражению растений, прежде всего по отношению к биотическим и абиотическим факторам, которые индуцируют некрозы клеток и тканей растений.
О локальной приобретенной устойчивости первоначально упомянули Yarwood (1960) и Ross (1961) в отношении вирусной устойчивости. Системная приобретенная устойчивость была выявлена Ross (1961) для табака, зараженного вирусом табачной мозаики.
Сейчас становится понятным, что системная приобретенная устойчивость эффективна в отношении, вероятно, только биотрофных патогенов. Ее развитие опосредовано салициловой кислотой, но молекулярные и биохимические детали этого явления пока плохо понятны. Более того, заражение растений некротрофными патогенами, возможно, вообще не индуцирует системную приобретенную устойчивость, хотя для окончательного вывода необходимы дальнейшие исследования.
Иммунитет, индуцированный ассоциированными с микроорганизмами молекулярными структурами (microbe—associatedmolecularpatterns, MAMPs) и иммунитет, индуцированный эффекторами патогенов.
Фитопатогенный организм, попадающий на растение, имеет различные консервативные молекулярные структуры на своей поверхности. В свою очередь, растения имеют рецепторы, которые выявляют эти структуры, и после выявления индуцируют активные защитные реакции. Эта «первая линия» активной обороны растений представляет собой иммунитет, индуцированный ассоциированными с микроорганизмами молекулярными структурами (MAMPs-индуцируемый иммунитет). Некоторое время назад MAMPs называли PAMPs (pathogen-associated molecular patterns), однако поскольку такие же молекулярные структуры имеют и не фитопатогенные микроорганизмы, в последнее время вместо аббревиатуры PAMPs рекомендуют использовать аббревиатуру MAMPs, но практически эти два обозначения можно рассматривать как синонимы.
По всей вероятности, во многих случаях именно MAMPs-индуцируемый иммунитет лежит в основе устойчивости нехозяина (самостоятельно или в сочетании с факторами пассивного иммунитета).
Успешные патогены, приспособившиеся к паразитированию на растениях, экспрессируют большое количество эффекторных молекул, в основном белков, которые подавляют индукцию MAMPs-индуцируемого иммунного отклика, таким образом прорывая эту «первую линию» обороны.
В свою очередь растения экспрессируют большой ассортимент так называемых генов устойчивости (генов R), белковые продукты которых являются рецепторами, специфически непосредственно или косвенно выявляющими присутствие эффекторных белков патогенов и запускающими реакции активной защиты. Эту форму иммунитета можно назвать иммунитетом, индуцированным эффекторами патогенов.
Что представляют собой MAMPs? Типичный MAMP – пептид, производное бактериального флагеллина, белка, который формирует жгутики. Другими элиситорами MAMP-типа являются липополисахариды, хитин грибов, фрагменты глюканов клеточной стенки грибов, эргостерол и т.д. Лучше всего изучен рецептор флагеллина. У арабидопсиса распознавание флагеллина зависит от рецепторного гена FLS2. В результате взаимодействия между флагеллином и продуктом гена FLS2, трансмембранной рецепторподобной протеинкиназой, происходит активация каскада митогенактивируемых протеинкиназ и в конечном итоге индукция комплекса защитных реакций, которые рассмотрели ранее.
Важно отметить, что врожденный иммунитет животных, и в частности человека, также индуцируется распознаванием MAMPs микроорганизмов, и у человека есть ген TLR5, кодирующий трансмембранный рецептор. TLR5 человека тоже распознает бактериальный флагеллин и также после распознавания запускает реакции врожденного иммунитета. Однако гомология последовательностей между белками FLS2 и TLR5 отсутствует, что свидетельствует об аналогии, а не о гомологии.
Кроме флагеллина, есть и другие MAMPs, и их обнаружение, а также поиск соответствующих рецепторов растений являются одним из направлений актуальных научных исследований в области иммунитета растений.
MAMPs-индуцируемый иммунитет часто называют базовой или базальной устойчивость растений.
Взаимодействие «ген-на-ген». Гены устойчивости и кодируемые ими белки
Гены, кодирующие детерминанты эффектор–индуцируемого иммунитета называют генами устойчивости. Специализированные эффекторы патогена, которые распознаются продуктами генов устойчивости, называют также белками авирулентности. Соответственно, кодирующие эти белки гены называют генами авирулентности.
Взаимодействие белков устойчивости и белков авирулентности на генетическом уровне представляет собой взаимодействие, называемое взаимодействием «ген-на-ген». Впервые его выявил в 1940-х годах американский фи-топатолог Флор (Flor, 1971) для взаимодействия растений льна с возбудителем ржавчины грибом Melampsoralini. Заражая разные сорта льна различными биотипами возбудителя, он обнаружил, что наблюдаемые данные хорошо объясняются предположением, что каждому гену устойчивости растения, имеющему доминантный аллель устойчивости, соответствует комплиментарный ген гриба, имеющий доминантный аллель авирулентности. Таким образом, при взаимодействии ген-на-ген устойчивость растений является специфической и индуцируется тогда, когда продукты генов устойчивости растительного организма распознают продукты генов, определяющих авирулентность фитопатогена. В дальнейшем это предположение было подтверждено для многих других патосистем, включающих самых различных растений-хозяев и патогенов, представленных вирусами, бактериями, грибами, нематодами, насекомыми и даже цветковыми растениями.
Как очевидно, в рамках современных представлений взаимодействие «ген-на-ген» – это специфическое взаимодействие эффекторов вирулентности патогена и белков устойчивости растений.
Гены R кодируют сравнительно небольшое число типов белков с общими консервативными аминокислотными мотивами. В число таких общих структурных тем входят сайт связывания нуклеотидов (nucleotide-binding site, NBS), обогащенный лейцином повтор (leucine-rich repeat, LRR), область с гомологией цитоплазматическим доменам рецепторного белка Toll Drosophila и рецептора интерлейкина-1 млекопитающих (Toll/Interleukin-1 resistance, TIR), суперспиральная структура (coiled–coil structure, СС), трансмембранный домен (transmembrane domain, TM) и домен серин/треонин–специфической протеинкиназы (serine/threonine protein kinase domain, PK).
Основное количество генов устойчивости растений кодируют внутриклеточные белки, имеющие домены NBS и LRR. Сайты связывания нуклеотидов (NBS) присутствуют в многочисленных АТФ– и ГТФ–связывающих белках и найдены у членов многих белковых семейств. Домены NBS белков-продуктов генов устойчивости растений характеризуются несколькими высоко консервативными аминокислотными мотивами, включая связывающую фосфат петлю (P-петлю) и киназные сайты.
В сторону карбоксильного конца по отношению к сайту связывания нуклеотидов, белки R этого класса имеют область обогащенных лейцином повторов (LRR). Этот домен состоит из неполных повторов, содержащих 23 или 24 аминокислоты, порядок расположения которых выявляет хорошее соответствие консенсусу цитоплазматического LRR: Лей-x-x-Лей-x-x-Лей-x-x-Лей-x-Лей-x-x-(Асн/Цис/Тре)-x-(x)-Лей-х-х-Иле-Про-x-x. Фактическое число повторов варьирует как между разными генами устойчивости, так и между членами одного генного семейства, и в типичном случае составляет от 10 до 40.
Класс NBS-LRR можно разделить на два подкласса в зависимости от структурной особенности NH2-терминальной области белков. Многие члены NBS-LRR класса генов устойчивости кодируют аминотерминальные домены с гомологией цитоплазматическим областям рецепторного белка Toll Drosophila и рецептора интерлейкина-1 млекопитающих. Этот домен белков R был обозначен как TIR.
Для членов другого подкласса характерным является формирование на аминном конце суперспиральной структуры (CC), которая представляет собой содержащие от двух до пяти спиралей узлы, имеющие специфическую упаковку аминокислот на поверхности раздела спираль–спираль. Вероятно, группа CC-NB-LRR генов охватывает множество субсемейств, варьирующих по размеру и локализации суперспирального домена. Ряд генов этого же подкласса кодируют белки, не имеющие определенного домена на аминотерминальном конце.
В 2002 году, в результате анализа генома растений арабидопсиса экотипа Col-0, были выявлены два новых семейства TIR-кодирующих генов и, соответственно, их белковых продуктов. У семейства TIR-X отсутствует домены NBS и LRR, а у семейства TIR-NBS отсутствует домен LRR. У данного экотипа арабидопсиса было выявлено 27 генов и три псевдогена семейства TIR-X и 20 генов и один псевдоген семейства TIR-NBS. Показано, что 85% генов TIR-X и 40% генов TIR-NBS постоянно экспрессируются в растениях на невысоком уровне. Присутствие обеих семейств генов TIR продемонстрировано также у хвойных растений. Вероятно, эти гены кодируют не функциональные белки, а являются попросту продуктами деградации или делеций TIR-NBS-LRR генов. Эти гены также могут кодировать аналоги адаптерных небольших TIR-белков, которые функционируют в системе врожденного иммунитета млекопитающих.
Кроме этого, в том же 2002 году клонирование гена устойчивости арабидопсиса RRS1-R, который обуславливает устойчивость к Ralstonia solanacearum, выявило, что этот TIR-NBS-LRR ген на карбоксильном конце содержит потенциальный сигнал ядерной локализации и домен WRKY. Этот консервативный домен, состоящий из 60 аминокислот, характерен для факторов транскрипции, найден только у растений и задействован во многих биологических процессах. Таким образом, вероятно, белок–продукт данного гена выполняет свою функцию в ядре клетки растения, являясь потенциальным фактором транскрипции.
Весьма интригующим оказался факт, что сайт связывания нуклеотидов R-белков растений имеет наибольшее подобие доменам NBS эффекторов гибели клетки белков CED-4 нематод и Apaf-1 млекопитающих, которые активируют вовлеченные в апоптоз протеазы CED-3 и caspase-9 соответственно. Подчеркивая эту гомологию, домен NBS белков растений часто называют доменом NB-ARC (чтобы выдвинуть на первый план разделяемые подобия этой области с человеческим Apaf-1, R-белками растений и белками CED-4 нематод). Одной общей, хотя и не строго универсальной, особенностью функции NBS-LRR-белков растений является сверхчувствительная гибель клетки в участке заражения в течение реакций устойчивости. Функциональное подобие между этим ответом и апоптозом животных и структурное подобие доменов NBS у R-белков растений и белков CED-4 и Apaf-1 является поразительным.
Удивительным является также структурное подобие между внутриклеточными NBS-LRR-белками растений и внутриклеточными NBS-LRR-белками млекопитающих (белками Nod). В геноме человека имеется около 30 генов Nod, продукты которых, вероятно, играют роль во врожденном иммунитете как внутриклеточные рецепторы, обусловливающие распознавание консервативных лигандов микробных патогенов типа липополисахаридов бактерий, то есть по сути являются MAMPs-рецепторами. У человека белки Nod опосредованно активируют фактор транскрипции NF-κΒ.
В 2001 году были обнаружены гены устойчивости, кодирующие белки, состоящие только из трансмембранного и суперспирального доменов. В этом клессе генов устойчивости пока известен только единственный локус RPW8 Arabidopsis, обуславливающий широкий спектр устойчивости к мучнистой росе (возбудители Erysiphe cichoracearum, E. cruciferarum, E. orontii и Oidium lycopersici). Этот локус содержит два доминантных гена, RPW8.1 и RPW8.2, имеющих только 50%-ную идентичность аминокислот. Каждый из них обуславливает широкий спектр устойчивости и кодирует небольшой, вероятно «заякоренный» в мембране белок с предполагаемыми суперспиральным и трансмембранным доменами и отсутствующей гомологией к другим известным белкам.
Другие классы генов устойчивости растений кодируют белки с внеклеточными регионами обогащенных лейцином повторов. Эти регионы либо связаны с внутриклеточным доменом протеинкиназы (такая структура генов устойчивости полностью соответствует рецептору флагеллина FLS2), либо не имеют внутриклеточного домена с известной функцией.
Белки, кодируемые генами устойчивости, являются рецепторами, которые непосредственно либо опосредованно распознают присутствие эффекторных белков патогенов в растительной клетке или в апопласте. Эффектор патогена, который распознается белками устойчивости, называют белком авирулентности. Далее запускаются реакции иммунитета, индуцируемого эффекторами патогенов. Как считается, эта форма иммунитета является более быстрой и более сильной версией иммунитета, индуцируемого ассоциированными с микробами молекулярными структурами. Однако качественных различий между этими формами иммунитета нет; рассмотренные выше реакции устойчивости растений наблюдаются и в одном, и в другом случаях.
Каким образом белки устойчивости обнаруживают присутствие в растительной клетке эффекторные белки патогенов? В некоторых случаях предполагается непосредственное взаимодействие белков устойчивости и авирулентности в цитоплазме растительной клетки; имеются также экспериментальные доказательства такого утверждения. В подобных случаях взаимодействие проходит по типу рецептор–лиганд, где рецептором служит белок устойчивости, а лигандом – белок авирулентности.
Во многих случаях, однако, непосредственного взаимодействия белков устойчивости и эффекторных белков патогена продемонстрировать не удалось. Альтернативной моделью является так называемая «гипотеза стража» (“guard hypothesis”), в соответствии с которой белки устойчивости являются «стражами» других белков растения – мишеней эффекторов вирулентности фитопатогенных организмов. В данном случае белок устойчивости обнаруживает не присутствие белка авирулентности как такового, а выявляет результат воздействия эффектора на мишень и, выявив изменение этой мишени, запускает реакции устойчивости. Например, в патосистеме арабидопсис–бактерия P. syringaeэффекторный белок AvrPphB бактерии является протеинкиназой и разрушает одну из протеинкиназ растения. Белок устойчивости хозяина RPS5 распознает продукты этого расщепления и запускает реакции устойчивости.
Итак, белок устойчивости растения прямо или косвенно распознает наличие или активность белка-эфектора фитопатогенного организма, и запускает реакции устойчивости. Как эти реакции запускаются? Пока еще во многом этот процесс остается непонятным; относительно путей передачи сигналов имеются только предварительные сведения, которые пока еще невозможно свести к сколько-нибудь полному обобщению. Некоторая информация по данному вопросу имеется в рекомендуемых для данного курса статьях.
Эффекторы патогенов и их мишени в растительных клетках
Пока еще мало что известно относительно механизмов подавления MAMPs-индуцируемого иммунитета растений эффекторными молекулами патогенов.
Первый вопрос связан с тем, что поскольку основная часть белков, кодируемых генами устойчивости растений, являются внутриклеточными и не имеют никаких внеклеточных доменов, то является очевидным, что эффекторные молекулы многих фитопатогенных организмов должны попадать внутрь растительной клетки. Как они туда проникают?
Ответ на этот вопрос очевиден для фитопатогенных вирусов; фитопатогенные бактерии, так же как и бактерии, патогенные для человека и животных, свои эффекторные молекулы, являющиеся факторами вирулентности, доставляют в цитоплазму клеток хозяина посредством системы секреции белка типа III. Однако каким образом этого достигают фитопатогенные грибы и оомицеты?
Фитопатогенные грибы и оомицеты – внеклеточные паразиты; даже если гифа гриба или гаустория проникают через клеточную стенку растения, они не попадают внутрь живой клетки.
В ходе заражения, патоген проникает через клеточную стенку хозяина и инвагинирует плазматическую мембрану клетки хозяина, формируя гаусторию. Таким образом, гаустория остается отделенной от цитоплазмы клетки хозяина стенкой гаустории, зоной, которую называют экстрагаусториальным матриксом, и экстрагаусториальной мембраной, которая формируется инвагинированной плазматической мембраной хозяина. Гаустории имеют большое значение в обеспечении хозяина питательными веществами. Считается также, что гаустория является центром клеточной коммуникации, через который проходит обмен информации между хозяином и патогеном при установлении успешных биотрофных отношений, однако по сегодняшний день природа этих коммуникационных процессов остается неясной. Некоторые гемибиотрофные грибы и оомицеты, такие как Phytophthora, также образуют гаустории, но в противоположность облигатным биотрофам эти патогены инициируют гибель клетки хозяина в течение более поздней некротрофной стадии инфекции.
Каким образом в клетку растения доставляют свои белки образующие гаустории грибы и оомицеты, долгое время это было совершенно непонятным, и только начиная с 2004 года, в этом вопросе был совершен определенный прорыв.
Одним из первых был клонирован кодирующий эффекторный белок ген AvrL567 возбудителя ржавчины льна гриба Melampsoralini. В дальнейшем был клонирован и ряд других генов. Все эти гены кодируют небольшие белки, имеющие сигнальные пептиды экспорта из клетки, за исключением генов возбудителя мучнистой росы. Таким образом, эти белки покидают гаустории и выходят в экстрагаусториальный матрикс. Первый важный вопрос – как они попадают в цитоплазму клетки растения-хозяина.
Исследования с грибам Uromyces fabae, возбудителем ржавчины бобовых, показали, что в экстрогаусториальном матриксе присутствуют несколько белков, секретированных гаусторией, но только один, белок авирулентности Uf-RTP1, попадал в клетку хозяина. Таким образом, механизм транспорта белков в клетку растения из экстрагаусториального матрикса действует избирательно.
Экстрагаусториальная мембрана, как считается, заново синтезируется по мере роста гаустории, и хотя непрерывность плазматической мембраны растения сохраняется, по многим физическим и биохимическим особенностям экстрагаусториальная мембрана отличается от остальной части плазмалеммы клетки растения. Экстрагаусториальный матрикс, по-видимому, является особым компартментом. Ржавчинные грибы имеют особый утолщенный регион посередине шейки гаустории; эта структура называется воротничком (neckband) и отделяет экстрагаусториальный матрикс от апопласта растения. Возбудители настоящей мучнистой росы также формируют на шейке гаустория подобный воротничок; однако у оомицетов такая структура неизвестна, за исключением Albugocandida, который образует подобную воротничку структуру, которая, однако, отличается от воротничка грибов. Тем не менее, у некоторых оомицетов найден отдельный электронноплотный регион между стенкой гаустория и отложением каллозы у растения; это отложение часто называют воротничком или папиллой. Предполагается, что это вещество образует пробку, аналогичную воротничку у грибов. Таким образом, гаустория окружена отдельным закрытым компартментом, формирование которого вероятно облегчает контроль потоков сигналов и питательных веществ.
Интригующим наблюдением у некоторых возбудителей ржавчины было обнаружение протяженных трубчатых образований экстрагаусториальной мембраны, которые проникают в цитоплазму клетки хозяина. Такие образования наблюдались в тесном контакте с эндоплазматическим ретикулюмом растения и с диктиосомами; это указывает на обмен материалами между экстрагаусториальной мембраной и внутренними мембранами клетки растения. Далее, на концах этих трубчатых образований в клетках растения наблюдалось почкование и формирование структур, напоминающих везикулы. Таким образом, вся эта система и может обеспечить перемещение белков гриба из экстрагаусториального матрикса в клетку хозяина.
Хотя граница раздела гаустория-хозяин представляет собой модифицированную окружающую среду, которая благоприятствует переносу белков, эффекторные белки ржавчинных грибов также могут иметь внутренний механизм транспорта через мембрану. Ряд исследований косвенно указывает, что по крайней мере ряд белков авирулентности имеют сигнал их поглощения клеткой растения посредством эндоцитоза с участием неизвестного пока рецептора хозяина.
Примечательной особенностью белков авирулентности фитопатогенных оомицетов является присутствие консервативного, недавно выявленного мотива, и полученные в последние полтора года доказательства указывают, что этот мотив действует как специфический сигнал нацеливания белка в клетку хозяина. Подобный сигнал отсутствует у возбудителей ржавчины; таким образом, ржавчинные грибы и оомицеты используют разные механизмы доставки белков авирулентности в клетки растения. Очень интересно, что данный сигнал оомицетов имеет удивительное подобие сигналу белков, продуцируемых возбудителями малярии человека (Plasmodiumfalciparum); эта гомология служит дополнительным доказательством эволюционного родства простейших с оомицетами.
Итак, эффектор фитопатогена оказался в клетке растения. Что он там делает? Какие процессы подавляет и на какие белки нацеливается? Ответы на эти вопросы являются ключевыми для понимания функции эффекторов. Наиболее полная к настоящему времени информация в этом направлении имеется для бактериальных патогенов.
Разные штаммы разных видов фитопатогенных бактерий доставляют от 15 до 30 разных эффекторов в клетки хозяина с использованием системы секреции белка типа III. Поскольку, по всей видимости, реакции иммунитета, индуцированного ассоциированными с микроорганизмами молекулярными структурами и иммунитета, индуцированного эффекторами патогенов, являются сходными и в значительной степени перекрываются, эффекторные белки вирулентности патогенов в той или иной степени влияют и на одну, и на другую формы иммунитета растений. Кроме того, из-за функциональной избыточности эффекторных белков очень сложно оценить вклад и механизм действия каждого из них. Однако накопленные к настоящему времени данные позволяют сделать определенные обобщения.
Так, некоторые эффекторы блокируют защитные отклики, связанные с укреплением клеточной стенки. Например, белок AvrPto бактерии P. syringaeблокирует образование папилл у арабидопсиса. Это блокирование независимо от салициловой кислоты и обусловлено, по всей вероятности, нарушением экспрессии генов секретируемых белков клеточной стенки растений. В то же время эффекторные белки AvrE и HopPtoM этой же бактерии блокируют образование папилл посредством ингибирования синтеза каллозы в зависимых от салициловой кислоты реакциях иммунитета.
Некоторые эффекторы производят манипулирование сигнальными путями гормонов растений для изменения характера реакций защиты. Как подробнее будет сказано далее, сигнальные пути, зависимые от салициловой кислоты (СК), ведут к индукции реакций устойчивости к биотрофным и гемибиотрофным патогенам (включающим обычно реакцию сверхчувствительности и индукцию системной приобретенной устойчивости), в то время как сигнальные пути, зависимые от жасмоновой кислоты (ЖК) и/или этилена, приводят к индукции реакций устойчивости к некротрофам, насекомым-вредителям и повреждениям. ЖК является фитогормоном, который индуцируется при повреждениях, питании насекомых-вредителей и поражении некротрофными патогенами. Кроме того, ЖК принимает участие в процессах роста и развития растений, в частности при старении растений. Сигнальные пути СК и ЖК являются антагонистическими – при индукции сигнальных путей одного типа сигнальные пути другого типа индуцироваться уже не могут. Говоря другими словами, если у растений индуцировать сигнальный путь ЖК, то у них будут подавлены сигнальные пути салициловой кислоты, необходимые для развертывания эффективной устойчивости к биотрофам, и наоборот. Это обстоятельство широко используют фитопатогенные биотрофные бактерии, в частностиP. syringae. Штаммы многих патоваров этих бактерий выделяю эффектор вирулентности небелковой природы – неспецифический фитотоксин коронатин. Данный фитотоксин является функциональным имитатором жасмоновой кислоты. Выделяя коронатин, бактерии вызывают у растений индукцию сигнальных путей ЖК; однако, поскольку эти бактерии являются биотрофными, опосредованная ЖК защита является неэффективной, и бактерии успешно паразитируют.
Помимо коронатина, по крайней мере еще два белковых эффектора вирулентности, AvrB и AvrRpt2, также индуцируют сигнальные пути жасмоновой кислоты, позволяя таким способом избежать индукции сигнальных путей СК. Молекулярная основа действия этих двух белков пока еще неизвестна.
Некоторые эффекторные белки бактерий вмешиваются в сверхчувствительную гибель клеток растений, которая почти всегда происходит при развитии реакций устойчивости, запускаемых белками-продуктами генов устойчивости растений в ответ на обнаружение эффекторных белков микроорганизмов. Интересно, что одни белковые эффекторы могут ингибировать реакцию сверхчувствительности, которая индуцируется распознаванием белками устойчивости растений других эффекторов патогенов. Иначе говоря, одни эффекторы могут маскировать присутствие других эффекторов. Например, белок HopAB1 (VirPphA) бактерии P. syrinage pv. phaseolicola маскирует присутствие эффекторного белка другого типа; при отсутствии HopAB1 у растений запускается реакции устойчивости (в том числе и сверхчувствительная гибель клеток растений). Однако если этот же штамм бактерий экспрессирует белок HopAB1, реакции сверхчувствительности не происходит.
Подобной активностью обладает также белок P. syringae pv. tomato HopAB2 (AvrPtoB). Он предотвращает сверхчувствительную гибель клеток растений томатов, которые в противном случае проявляют эффективную устойчивость, индуцируемую взаимодействием белков устойчивости растений с другими эффекторами патогена. Однако интересно, что ингибирование реакции устойчивости белком HopAB2 происходит не во всех случаях – при взаимодействии некоторых белков устойчивости растений с соответствующими эффекторными белками патогена реакция сверхчувствительности не предотвращается. Это свидетельствует о весьма сложных и запутанных молекулярных подробностях действия эффекторного белка.
Некоторые эффекторные белки патогенов предотвращают сверхчувствительную гибель клеток, индуцируемую в рамках устойчивости нехозяина (например, HopA1 (HopPsyA) P. syringae у растений арабидопсиса и табака).
Для некоторых эффекторных белков бактерий известны молекулярные мишени-белки растений; более подробная информация имеется в предлагаемой дополнительной литературе.
Роль эффекторных белков фитопатогенных вирусов и фитопатогенных грибов и оомицетов ясна значительно меньше, чем бактериальных эффекторов.
Контрастные механизмы устойчивости к биотрофам и некротрофам
Растения могут подвергаться атакам потенциальных патогенов, и их многочисленные защитные механизмы могут включаться атакой патогена. Однако для успешного выживания и размножения защитный отклик должен тонко регулироваться, поскольку активация защитного отклика оказывает вредное влияние на рост растений.
Молекулярные механизмы, лежащие в основе активации защитного отклика, исключительно сложны. Если говорить об устойчивости, обусловленной взаимодействием белков-продуктов генов устойчивости и генов авирулентности, то эта устойчивость обычно сопровождается окислительной вспышкой, то есть быстрым образованием реактивных видов кислорода. Продуцирование ROS необходимо для другого компонента устойчивости, сверхчувствительной гибели клеток. Зависимая от генов R устойчивость также ассоциирована с активацией сигнальных путей, зависимых от салициловой кислоты (SA).
Однако некоторые другие защитные отклики растений контролируются механизмами, зависимыми от этилена (ET) и/или жасмоновой кислоты (JA). Эти последние механизмы в значительной степени перекрываются с откликами на повреждение, которые также находятся под контролем этилена и жасмоната. Сигнальные пути, связанные с SA, JA, и ET, в значительной степени взаимодействуют. SA и JA обладают взаимным ингибиторным действием в отношении экспрессии многих генов. Индуцированная экспрессия ряда генов требует как ET, так и JA, тогда как экспрессия других генов нуждается только в одном сигнале из этих двух. Известны также случаи негативного взаимодействия между передачами сигналов ET и JA.
У арабидопсиса при индукции реакций устойчивости синтезируется ряд фитоалексинов. Для одного из них, камалексина, имеется мутанты с нарушенной функцией гена синтеза камалексина, PAD3, который кодирует P450 монооксигеназу CYP71B15, которая вероятно является ферментом синтеза камалексина. Использование соответствующей мутации позволяет оценить значение камалексина в устойчивости.
При исследованиях арабидопсиса в качестве биотрофных патогенов используют оомицет P. parasitica, вызывающий ложную мучнистую росу, а также возбудители настоящей мучнистой росы Erysiphe orontii и Erysiphe cichoracearum. К биотрофам также относится бактерия P. syringae. Однако в настоящее время ее чаще рассматривают как гемибиотрофа.
Наиболее изученные некротрофные патогены арабидопсиса – грибы Botrytis cinerea and Alternaria brassicicola.
Сигнальные пути, зависимые от салициловой кислоты
Сверхчувствительная гибель клеток или нападение определенных патогенов запускают активацию зависимых от SA сигнальных путей. Уровни SA увеличиваются, и это приводит к активации различных генов защиты, включая PR-1. Основная часть SA у арабидопсиса синтезируется из изохоризмата, а не по пути фенилаланина. Однако некоторая часть ее синтезируется через фенилаланин.
Ген NPR1 действует ниже точки биосинтеза салициловой кислоты в салицилат–зависимом пути передачи сигналов. Когда уровни SA низкие, белок NPR1 существует в виде олигомерной формы в цитоплазме. При повышении концентрации салициловой кислоты олигомеры диссоциируют на мономеры из-за восстановления дисульфидных связей, соединяющих олигомеры. Далее мономеры входят в ядро, где они взаимодействуют с факторами транскрипции TGA-типа. Для активации экспрессии гена PR-1 необходимы TGA 2, 5 и 6. Для полной экспрессии данного гена необходим также фактор транскрипции WRKY70.
Некоторые зависимые от SA защитные отклики являются независимыми от гена NPR1, что свидетельствует о существовании другой ветви пути передачи сигналов, связанного с салициловой кислотой. Фактор транскрипции AtWhy1 индуцируется заражением бактерией P. parasitica и обработкой SA, но не зависит от NPR1. Данный фактор транскрипции также является необходимым для полной экспрессии гена PR-1. Таким образом, фактор транскрипции AtWhy1 может представлять собой часть зависимого от салициловой кислоты, но независимого от NPR1 сигнального пути. А в экспрессию салициловой кислотой гена R-1, как очевидно, вносят вклад оба сигнальных пути.
Упорядочить все события, происходящие в зависимом от салициловой кислоты сигнальном пути непросто, поскольку он включат несколько обратных связей. Гибель клетки запускает образование салициловой кислоты, но салициловая кислота также запускает гибель клетки. Сверхчувствительная гибель клеток приводит к активации сигнала SA по всему астению. В последствии, растение, зараженное авирулентным патогеном, развивает устойчивость к последующему заражению патогенами, которые чувствительны к защитным откликам, регулируемым через салициловую кислоту. Это явление называют системной приобретенной устойчивостью (SAR).
Сигнальные пути, зависимые от жасмоновой кислоты и этилена
Зависимые от жасмоната сигнальные пути функционируют посредством усиления синтеза JA в ответ на атаку патогена с последующим увеличением экспрессии защитных генов, таких как PDF1.2. Зависимые от жасмоновой кислоты сигнальные пути также важны в фертильности растений, в ответ на повреждение и питание насекомых. Некоторые регулируемые жасмоновой кислотой гены также регулируются этиленом. В случае PDF1.2, индукция экспрессии требует и JA и ET. В противоположность этому, индуцируемый жасмоновой кислотой ген VSP1 для своей экспрессии не требует этилена.
В регуляцию уровней JA, по-видимому, вовлечены синтазы целлюлозы растений. Ген JAR1 кодирует аминосинтетазу жасмоновой кислоты, которая может формировать коньюгаты между жасмоновой кислотой и несколькими аминокислотами, включая изолейцин. Именно изолейциновый коньюгат может быть активной формой жасмоновой кислоты.
Жасмоновой кислотой индуцируется целый ряд факторов транскрипции, в частности ERF1, RAP2.6 (семейство AP2), и JIN1 (AtMYC2). ERF1 объединяет сигналы от ЖК и этилена, и его экспрессия требует обоих гормонов. Для генов, которые были изучены в этом отношении к настоящему времени, установлено, что те, которые индуцируются ERF1, репрессируются JIN1. В свою очередь гены, которые активируются фактором транскрипции JIN1, репрессируются ERF1. Первая группа генов, индуцируемая ERF1, по-видимому важна в устойчивости к болезням, поскольку сверхэкспрессия ERF1 на фоне мутации jin1 приводит к повышению устойчивости к некротрофным патогенам. Детальная роль фактора транскрипции RAP2.6 остается пока не изученной.
Взаимодействия между сигнальными путями СК и ЖК/ЭТ
Имеются множественные точки взаимодействия между путями передачи сигналов СК и ЖК/ЭТ. В большинстве случаев эти взаимодействия представляют собой взаимную репрессию, хотя некоторые гены индуцируются как экзогенной СК, так и эндогенной ЖК. Генетические нарушения, которые приводят к повышению уровня СК, обычно ассоциированы со сниженным уровнем ЖК. Молекулярные механизмы, ответственные за такое негативное взаимодействие между путями передачи сигналов СК и ЖК плохо понятны. По всей видимости, это взаимодействие осуществляется во многих точках.
Механизмы устойчивости к биотрофам и некротрофам
По стратегиям паразитизма, фитопатогенные организмы подразделяются на биотрофов, некротрофов и гемибиотрофов. В случае биотрофов, легко представить, что обусловленная генами R устойчивость и путь передачи сигналов через СК приведет к устойчивости, поскольку в случае сверхчувствительной гибели клеток растения такой патоген будет лишен пищи. Однако в случае некротрофов можно представить, что запрограммированная гибель клеток будет просто облегчать жизнь патогену.
Поддержка этому предположению была получена при проведении экспериментов с мутантными растениями арабидопсиса с дефектами в разных путях передачи сигналов. Мутантные растения, у которых была блокирована передача сигналов через салициловую кислоту, действительно утрачивали устойчивость к биотрофному оомицету Peronospora parasitica, но мутации не оказывали влияние на устойчивость к некротрофу Alternaria brassicicola. И наоборот, мутация, которая блокировала путь передачи сигналов через ЖК, в значительной степени снижала устойчивость к A. brassicicola, но не влияла на устойчивость к P. parasitica. Подобные наблюдения приводят к предположению, что защитные отклики растения «подогнаны» под атакующего патогена; при этом зависимая от СК защита действует против биотрофов, а зависимые от ЖК и ЭТ отклики действуют против некротрофов. Однако, как это часто бывает с простыми и элегантными объяснениями, дальнейшие исследования выявили, что в общем это предположение верное, но реальная ситуация значительно сложнее.
В общем, исследования с целым рядом биотрофных, гемибиотрофных и некротрофных патогенов арабидопсиса позволили установить, что устойчивость к биотрофам зависит от путей передачи сигналов салициловой кислоты, и не зависит от путей передачи сигналов жасмоновой кислоты и синтеза фитоалексина камалексина. Устойчивость к некротрофам опосредована путями передачи сигналов жасмоновой кислоты и/или этилена, зависит также от синтеза фитоалексина и не зависит от путей передачи сигналов салициловой кислоты.
Однако, например, в случае биотрофов связанные с ЖК и ЭТ защитные отклики могут быть эффективными, если их индуцировать до заражения патогеном. С другой стороны, некоторые компоненты зависимой от салициловой кислоты устойчивости могут быть необходимыми для патологического процесса, вызываемого некротрофными грибами, в частности B. cinerea. Так, в 2000 году было высказано предположение, что гибель клеток, вызываемая B. cinereaчерез индукцию сверхчувствительной гибели клеток, является важным компонентом вирулентности гриба. Гибель клеток растений, вызываемая B. cinerea, во многих отношениях напоминает сверхчувствительную гибель клеток: она ассоциирована с накоплением форм активного кислорода и с экспрессией в табаке ассоциированного со сверхчувствительным откликом гена HSR203J. Предварительное заражение арабидопсиса авирулентным штаммом биотрофа P. syringae приводит к сверхчувствительному отклику и усиливает рост B. cinerea. Иначе говоря, индукция устойчивости к биотрофному патогену повышает восприимчивость растения к некротрофному патогену. Пока сложно сказать, в какой степени можно обобщить это утверждение. Если вспомнить, что механизм действия специфических фитотоксинов также состоит в индукции реакции сверхчувствительности, то есть в индукции защитного отклика, который однако в таком случае не защищает растение, а наоборот делает его более доступным для патогена, то это может оказаться практически правилом – некротрофы «паразитируют» на защитных реакциях растения, эффективных против биотрофов. Однако для обоснованных утверждений такого рода исследователям необходимо накопить значительно больший объем информации.
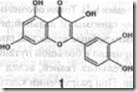
![clip_image002[1] clip_image002[1]](/images/clip_image0021_thumb.jpg)